ВВЕДЕНИЕ
Старение населения, увеличение продолжительности жизни и неблагоприятные изменения в образе жизни, такие как нездоровое питание и снижение физической активности в развитых странах, вероятно, в будущем приведут к увеличению распространенности различных глазных заболеваний. В первую очередь это касается заболеваний сетчатки [1]. Прогнозируется, что к 2040 г. в мире у 288 миллионов человек может развиться возрастная макулярная дегенерация (ВМД), клинически характеризующаяся друзами, изменением пигментного эпителия сетчатки, хориоидальной неоваскуляризацией (ХНВ), кровоизлияниями, экссудацией и на поздних стадиях географической атрофией [2, 3, 4].
Ведущей глобальной причиной потери зрения во многих странах считается диабетическая ретинопатия (ДР) [5]. Согласно исследованиям отмечается, что число взрослых людей с ДР во всем мире вырастет с 103,12 млн. в 2020 г. до 160,50 млн. к 2045 г., а ДР, угрожающая зрению, возрастет с 28,54 млн в 2020 г. до 44,82 млн к 2045 г. [6]. Диабетический макулярный отек (ДМО) – офтальмологическое осложнение сахарного диабета, ведущее к потере центрального зрения, встречающееся как на ранних, так и на поздних стадиях ДР [7].
Другой патологией, приводящей к снижению зрения с возрастом, является эпиретинальная мембрана (ЭРМ). ЭРМ представляет собой преретинальное скопление коллагеновых клеток различной этиологии [8]. Данная патология чаще встречаются у пожилых людей, при этом патологоанатомические исследования показывают распространенность у лиц в возрасте 50 лет составляет 2% и до 20% у лиц в возрасте 75 лет. ЭРМ может носить идиопатический характер, а также может быть связана с различными глазными заболеваниями: задняя отслойка стекловидного тела (ЗОСТ) (частота 75-93%), разрывы и отслойки сетчатки, ДР, ДМО, воспалительные и сосудистые заболевания сетчатки. Формирование ЭРМ без ЗОСТ может предрасполагать к витреомакулярному тракционному синдрому с развитием макулярного отека [9].
Еще одним распространенным заболеванием сетчатки является центральная серозная хориоретинопатия (ЦСХ), при котором возникает серозная отслойка нейроэпителия (НЭ) над зоной просачивания из хориокапилляров через ПЭС [10]. ЦСХ чаще встречается в возрасте 20- 55 лет, однако, ее можно диагностировать и в пожилом возрасте. Интересно, эти пожилые пациенты более склонны к ХНВ [11].
Помимо вышеперечисленных заболеваний сетчатки, в практике врача-офтальмолога нередко встречается кистозный макулярный отек при окклюзии центральной вены сетчатки и ее ветвей, пигментном ретините, после хирургии катаракты (синдром Ирвина-Гасса) и др. [12].
Золотым стандартом диагностики заболеваний сетчатки считается оптическая когерентная томография (ОКТ). Благодаря ОКТ можно получить послойную картину сетчатки in vivo с разрешением 5–7 микрон и идентифицировать даже небольшие изменения, характерные для начальной стадии ретинальной патологии [13]. Поэтому для врачей-офтальмологов крайне важно точно интерпретировать изображения ОКТ.
Принимая во внимание текущие тенденции роста, старения населения планеты встает вопрос о раннем выявлении и профилактике заболеваний сетчатки, однако, система здравоохранения может оказаться не в состоянии справиться с растущим бременем. Поэтому офтальмологическая служба нуждается в автоматическом, быстром, экономичном, но при этом высокочувствительном и специфичном методе выявления патологии глазного дна. Платформы на основе искусственного интеллекта (ИИ) могут стать потенциальным дополнением к диагностике и лечению заболеваний сетчатки в практике врача-офтальмолога.
Целью данного исследования является разработка алгоритма сегментации визуальных признаков кистозного макулярного отека (в том числе ДМО), ВМД (ретинальных друз и ХНВ), ЦСХ и ЭРМ на цифровых сканах ОКТ сетчатки глаза. Для сегментации выбраны следующие патологические признаки: интраретинальные кисты, субретинальная жидкость, субретинальный гиперрефлективный материал, отслойка ретинального пигментного эпителия, эпиретинальная мембрана, ретинальные друзы.
Для достижения поставленной цели потребовалось решить ряд научно-технических задач:
1. Сбор и подготовка базы медицинских данных – цифровых сканов структурной ОКТ сетчатки глаза.
2. Разметка медицинских данных. Размечаемые признаки: интраретинальные кисты, субретинальная жидкость, субретинальный гиперрефлективный материал, отслойка ретинального пигментного эпителия, эпиретинальная мембрана, ретинальные друзы.
3. Построение и обучение алгоритма ИИ на базе размеченных данных. Реализация нейронных сетей и процесс их обучения осуществляется с помощью фреймворка глубокого обучения TensorFlow. Данный фреймворк имеет большой функционал с точки зрения построения архитектур нейронных сетей и оптимизирован для работы с GPU (графические вычислительные ядра).
4. Оценка параметров точности работы алгоритма на валидационной базе данных.
МАТЕРИАЛЫ И МЕТОДЫ
Обучающие и тестовые данные
В ходе разработки алгоритмов машинного обучения используются большие массивы данных. Все данные подразделяются на обучающую и тестовую базу. Обучающая база служит непосредственно для разработки алгоритма, тестовая – для проверки точности его работы. При этом очень важно, чтобы данные из обучающей базы не попали в тестовую.
В качестве обучающей и валидационной баз данных использовались цифровые сканы ОКТ сетчатки глаза из открытой базы данных «Labeled Optical Coherence Tomography (OCT) for Classification» [14].
Объем обучающей базы данных составил 3500 сканов ОКТ. Объем валидационной базы данных составил 650 сканов ОКТ. Наличие патологических изменений были валидированы врачами-офтальмологами.
Разметка данных
Разметка проводилась вручную врачамиофтальмологами путем выделения полигоном соответствующего участка изображения с одним из признаков. Размечались следующие признаки: интраретинальные кисты, субретинальная жидкость, субретинальный гиперрефлективный материал, отслойка ретинального пигментного эпителия, эпиретинальная мембрана, ретинальные друзы.
На рисунке 1 представлен пример разметки признаков «Интраретинальные кисты», «Субретинальная жидкость», «Ретинальные друзы», «Отслойка ретинального пигментного эпителия».
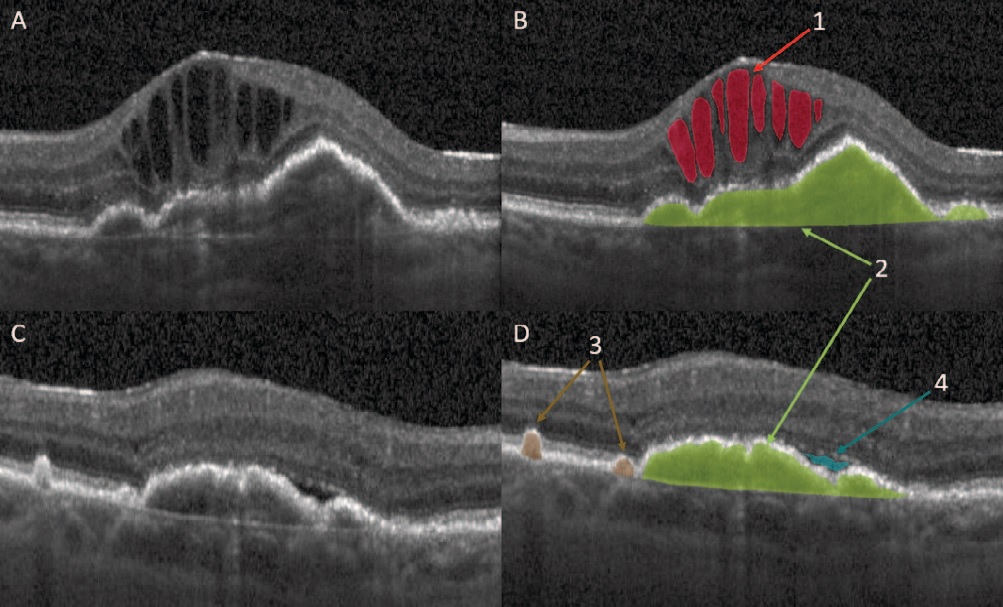
Рис. 1. Разметка признаков “Интраретинальные кисты”, “Субретинальная жидкость”, “Ретинальные друзы”, “Отслойка ретинального пигментного эпителия”: A, С – сканы ОКТ без разметки; B, D – сканы ОКТ с размеченными признаками патологий. 1 – “Интраретинальные кисты”, 2 – “Отслойка ретинального пигментного эпителия”, 3 – “Ретинальные друзы”, 4 – “Субретинальная жидкость”
Fig. 1. Marking of signs “Intraretinal cysts”, “Subretinal fluid”, “Retinal drusen”, “Retinal pigment epithelium detachment”: A, C – OCT images without marking; B, D – OCT images o with marked signs of pathologies. 1 – “Intraretinal cysts”, 2 – “Retinal pigment epithelium detachment”, 3 – “Retinal drusen”, 4 – “Subretinal fluid”
Архитектура алгоритма
Алгоритм сегментации визуальных признаков патологий на цифровых сканах ОКТ сетчатки глаза представлен на рисунке 2.
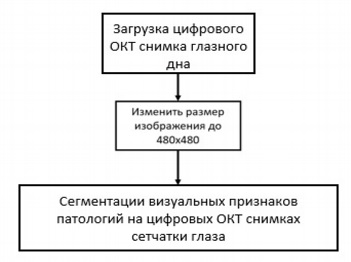
Рис. 2. Алгоритм сегментации визуальных признаков патологий на цифровых сканах ОКТ сетчатки глаза
Fig. 2. Segmentation algorithm for signs of pathologies on digital OCT images of the retina
Для обучения искусственных нейронных сетей, применяемых в системе, формируется набор обучающих данных, состоящий из размеченных сканов ОКТ сетчатки глаза. Визуальные признаки патологий (интраретинальные кисты, субретинальная жидкость, субретинальный гиперрефлективный материал, отслойка ретинального пигментного эпителия, эпиретинальная мембрана, ретинальные друзы) размечаются многоугольниками.
В алгоритме применяется сегментационная искусственная нейронная сеть для решения задачи семантической сегментации визуальных признаков патологий сетчатки глаза.
Цифровые сканы ОКТ сетчатки глаза имеют удовлетворительную контрастность, позволяющую не использовать дополнительную предобработку изображения для улучшения видимости выбранных признаков патологий.
Изображения подаются на вход сегментационной искусственной нейронной сети измененные до размера 480х480 пикселей.
Ввиду разнородности структур сегментируемых визуальных признаков патологий сетчатки глаза задача семантической сегментации является достаточно сложной. Данная задача решается применением актуальных и производительных архитектур искусственных нейронных сетей. В качестве основы для архитектуры нейронной сети используется архитектура EfficientNetB0 + FPN с модификациями структуры [12, 13]. По маскам, полученным в результате сегментации признаков, определяются координаты точек контуров найденных признаков и оцениваются параметры контуров, например, количество признаков. Полученные параметры контуров могут быть использованы для реализации рекомендаций по проведению дифференциальной диагностике пациента. На рисунке 3 представлен пример сегментации алгоритмом ИИ патологических признаков на сканах структурной ОКТ.
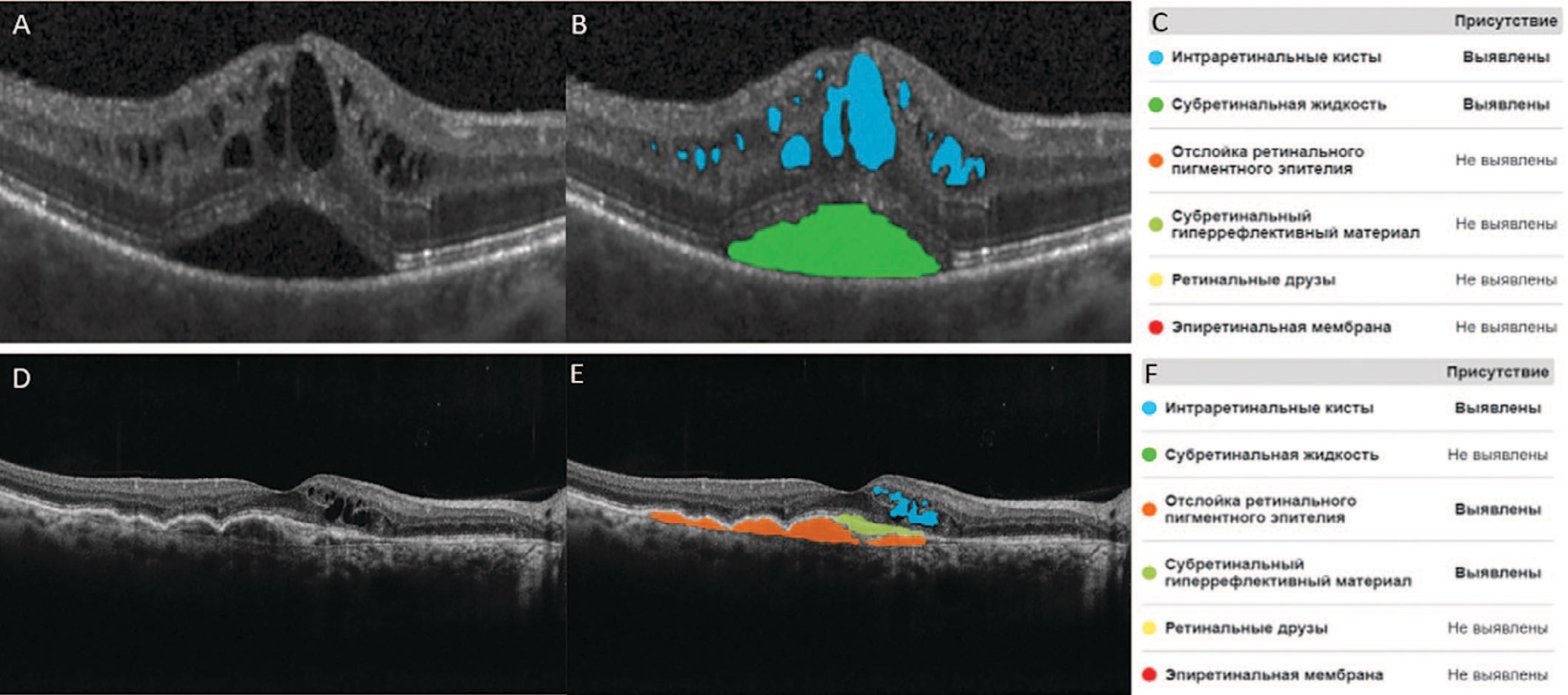
Рис. 3. Пример сегментации алгоритмом ИИ патологических признаков на сканах структурной ОКТ. A, D – исходные сканы ОКТ сетчатки глаза; B, E – сканы ОКТ сетчатки глаза с сегментированными патологическими признаками; С, F – отчетные таблицы
Fig. 3. An example of AI segmentation of pathological features on OCT scans. A, D – original OCT scans; B, E – OCT scans with segmented pathological features; C, F – reporting tables
Оценка параметров точности работы алгоритма
Реализация данной задачи начинается с определения требований (метрик (критериев) качества) к разрабатываемой модели. Для оценки точности работы методов ИИ с использованием тестового набора данных вычисляют несколько параметров точности:
• количество правильных положительных срабатываний — TP (True positives);
• количество неправильных положительных срабатываний — FP (False positives);
• количество неправильных отрицательных срабатываний — FN (False negatives);
• количество правильных отрицательных срабатываний — TN (True negatives);
По этим параметрам вычисляются следующие меры точности
• Accuracy (точность срабатывания) — процент правильно найденных положительных и отрицательных случаев, Accuracy = TP+TN/общее число случаев – Recall / Sensitivity (чувствительность) — процент правильно предсказанных положительных случаев из всех положительных случаев, Recall = TP / (TP + FN)
• Specificity (специфичность) — процент правильно предсказанных отрицательных случаев из всех отрицательных случаев, Specificity = TN / (TN + FP)
Исходя из полученных показателей чувствительности и специфичности строится ROC – кривая (Receiver Operator Characteristic – операционная характеристика приемника), которая показывает зависимость количества верно классифицированных положительных примеров от количества неверно классифицированных отрицательных примеров. Количественную интерпретацию ROC дает показатель AUC (англ. area under ROC curve) — площадь под ROC-кривой, по которой можно оценивать качество предсказаний нейросети. У идеального алгоритма AUC будет равна 1, соответственно, чем AUC ближе к 1, тем качественнее предсказания нейросети.
Валидационная база данных представляет собой набор неразмеченных сканов ОКТ и отчетные таблицы с указанием наличия или отсутствия каждого признака для каждого скана (рис. 4). Отчетная таблица составлялась на основе заключений трех врачей-офтальмологов. В процессе валидации данный набор снимков пропускается через обученную искусственную нейронную сеть с подсчетом параметров TP, FP, TN, FN и последующим расчетом метрик Accuracy, Precision, Recall, Specificity и AUC.
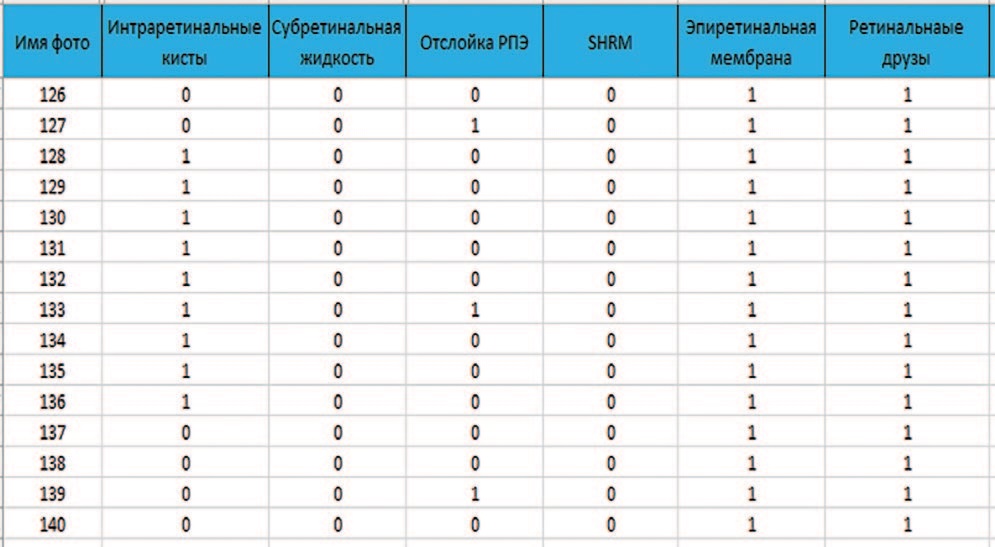
Рис. 4. Сегмент таблицы валидационного датасета
Fig. 4. Segment of the validation dataset table
РЕЗУЛЬТАТЫ
Результаты оценки параметров точности работы алгоритма на валидационной базе данных приведены в таблице 1. На рисунке 5 приведены ROC – кривые и показатели AUC для каждого признака.
Таблица 1. Оценка параметров точности работы алгоритма
Table 1. Estimation of the parameters of the accuracy of the algorithm
| № п/п/ No. | TP | TN | FP | FN | Accuracy | Recall | Specificity |
|---|---|---|---|---|---|---|---|
| Интраретинальные кисты | 145 | 513 | 3 | 10 | 98,06 | 93,54 | 99,41 |
| Субретинальная жидкость | 150 | 496 | 8 | 17 | 96,27 | 89,82 | 98,41 |
| Отслойка ретинального пигментного эпителия | 221 | 402 | 35 | 13 | 92,84 | 94,44 | 91,99 |
| Субретинальный гипер-рефлективный материал | 89 | 552 | 17 | 13 | 95,52 | 87,25 | 97,01 |
| Эпиретинальная мембрана | 200 | 397 | 32 | 42 | 88,97 | 82,64 | 92,54 |
| Ретинальные друзы | 231 | 367 | 42 | 31 | 89,12 | 88,16 | 89,73 |
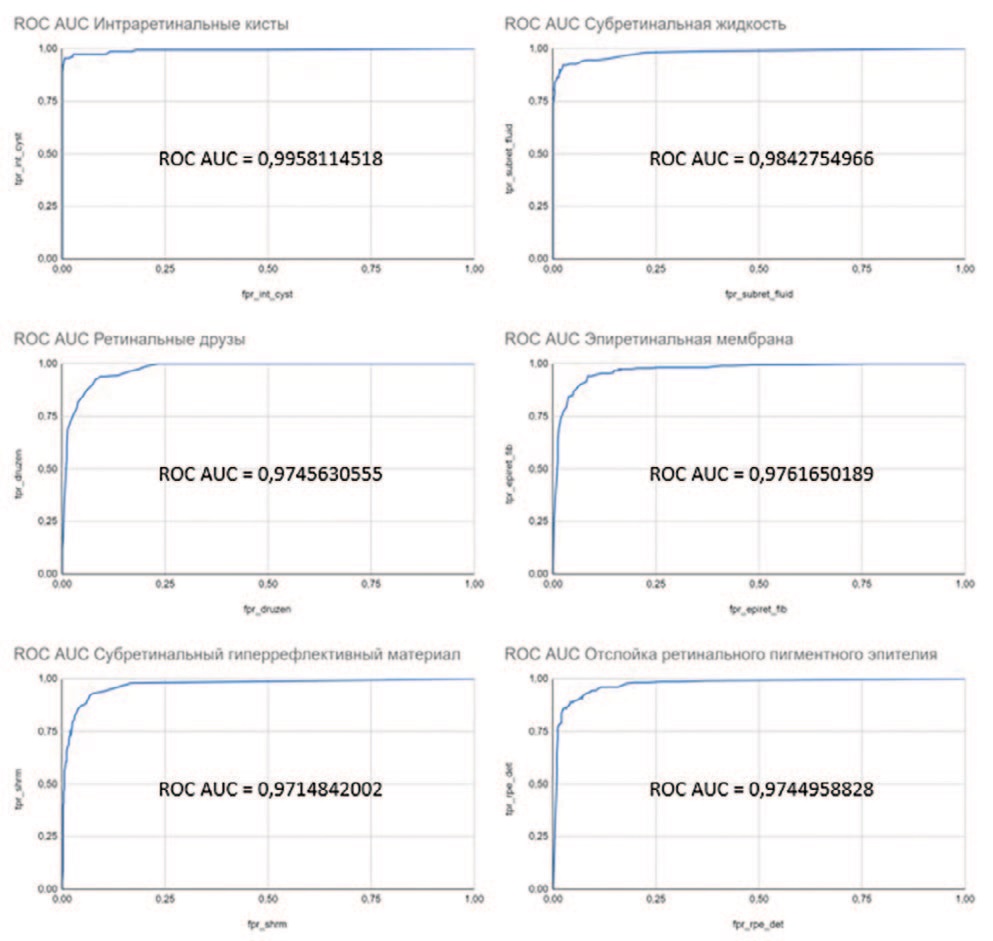
Рис. 5. ROC – кривые и показатели AUC для каждого признака
Fig. 5. ROC curves and AUC values for each feature
ОБСУЖДЕНИЕ
Разработанный алгоритм ИИ позволяет сегментировать признаки кистозного макулярного отека (в том числе ДМО), ВМД (ХНВ и ретинальных друз), ЦСХ и ЭРМ на цифровых сканах ОКТ сетчатки глаза с достаточно высоким уровнем точности и может быть положен в основу системы поддержки принятия врачебных решений (СППВР) для диагностики патологий сетчатки глаза. В предлагаемом алгоритме осуществляется сегментация и подсвечивание каждого отдельного признака, что делает сервис прозрачным, понятным и удобным для врача.
Важнейшим этапом разработки алгоритмов ИИ является работа с данными. Наличие достаточного объема деперсонализированных медицинских данных и разметка данных квалифицированными врачами-офтальмологами является неотъемлемым условием создания качественного продукта.
СППВР на основе алгоритмов ИИ может быть использована в программах скрининга офтальмологической патологии.
В частности, СППВР может оказать помощь в ситуациях, требующих обследования большого числа пациентов за короткое время, с оценкой стадии и динамики болезни, а также с выявлением необходимости оказания неотложной офтальмологической помощи. Снижение нагрузки на врачей, а также расширение доли охвата населения с применением СППВР может сделать скрининг более успешным.
Развитие телемедицины в области скрининга патологии глазного дна не может пройти без применения портативных устройств средств скрининга [15, 16]. Активно разрабатываются многочисленные приложения на базе ИИ, призванные помочь врачам выполнять различные задачи на месте оказания медицинской помощи, в частности, в диагностике патологии сетчатки [17, 18].
ЗАКЛЮЧЕНИЕ
Таким образом, разработанный алгоритм сегментации патологических признаков на сканах ОКТ имеет достаточно высокие показатели точности работы и имеет хорошие перспективы применения в процессе скрининга офтальмологической патологии. Развитие мобильных устройств для получения сканов ОКТ сетчатки глаза станет дополнительным фактором применения разработанного алгоритма в приложениях телемедицины.
На основе данного алгоритма была разработана офтальмологическая платформа Retina.AI, позволяющая проводить автоматизированный анализ цифровых сканов ОКТ сетчатки глаза и выявлять визуальные признаки патологий на основе алгоритмов ИИ.
ЛИТЕРАТУРА
1. Purola PKM, Nаttinen JE, Ojamo MUI, Koskinen SVP, Rissanen HA, Sainio PRJ, et al. Prevalence and 11-year incidence of common eye diseases and their relation to health-related quality of life, mental health, and visual impairment. Qual Life Res 2021 Aug;30(8):2311-2327. https://doi.org/10.1007/s11136-021-02817-1.
2. Stahl A. The Diagnosis and Treatment of Age-Related Macular Degeneration. Dtsch Arztebl Int 2020 Jul 20;117(29-30):513-520. https://doi.org/10.3238/arztebl.2020.0513.
3. Wong WL, Su X, Li X, Cheung ChMG, Klein R, Cheng ChYu, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014;2:106–16.
4. Chew EY, Clemons TE, Agr—n E, Launer LJ, Grodstein F, Bernstein PS, et al. Effect of omega-3 fatty acids, lutein/zeaxanthin, or other nutrient supplementation on cognitive function: the areds 2 randomized clinical trial. JAMA 2015;314:791–801.
5. Amoaku WM, Ghanchi F, Bailey C, Banerjee S, Banerjee S, Downey L, et al. Diabetic retinopathy and diabetic macular oedema pathways and management: UK Consensus Working Group. Eye (Lond) 2020 Jun;34(Suppl 1):1-51. https://doi.org/10.1038/s41433-020-0961-6. Erratum in: Eye (Lond) 2020 Oct;34(10):1941-1942.
6. Teo ZL, Tham YC, Yu M, et al. Global Prevalence of Diabetic Retinopathy and Projection of Burden through 2045: Systematic Review and Metaanalysis. Ophthalmology 2021;128(11):1580-1591. https://doi.org/10.1016/ j.ophtha.2021.04.027.
7. Bhavsar AR. Diabetic Retinopathy. Updated: Sep 02, 2021. [Electronic resource]. URL: https://emedicine.medscape.com/article/1225122- overview#a1.
8. Fung AT, Galvin J, Tran T. Epiretinal membrane: A review. Clin Experiment Ophthalmol 2021;49:289–308. https://doi.org/10.1111/ceo.13914.
9. Oh KT, Drouilhet JH. Epiretinal Membrane. Updated: Jan 02, 2020. [Electronic resource]. https://emedicine.medscape.com/article/1223882- overview#a4.
10. Semeraro F, Morescalchi F, Russo A, Gambicorti E, Pilotto A, Parmeggiani F. Central Serous Chorioretinopathy: Pathogenesis and Management. Clin Ophthalmol 2019 Dec 2;13:2341-2352. https://doi.org/10.2147/ OPTH.S220845.
11. Oh KT. Central Serous Chorioretinopathy. [Electronic resource]. Updated: Jun 18, 2019 https://emedicine.medscape.com/article/1227025- overview#a4.
12. Tan M, Le QV. EfficientNet: Rethinking Model Scaling for Convolutional Neural Networks, International Conference on Machine Learning. https://doi.org/10.48550/arXiv.1905.11946.
13. Lin TYi, Dollаr P, Girshick R, He K, Hariharan Bh, Belongie S. Feature Pyramid Networks for Object Detection 2017. https://doi.org/10.48550/ arXiv.1612.03144.
14. Daniel K, Kang Zh, Michael G. Labeled Optical Coherence Tomography (OCT) and Chest X-Ray Images for Classification. Mendeley Data V2. https://doi.org/10.17632/rscbjbr9sj.2.
15. Song G, Chu KK, Kim S, Crose M, Cox B, Jelly ET, et al. First Clinical Application of Low-Cost OCT. Transl Vis Sci Technol 2019 Jun 28;8(3):61. https://doi.org/10.1167/tvst.8.3.61. PMID: 31293815; PMCID: PMC6602122.
16. Duan Z, Huang K, Luo Z, Ma K, Wang G, Hu X, et al. Portable boomtype ultrahigh-resolution OCT with an integrated imaging probe for supine position retinal imaging. Biomed Opt Express 2022 May 10;13(6):3295-3310. https://doi.org/10.1364/BOE.456435. PMID: 35781965; PMCID: PMC9208590.
17. Gupta S, Thakur S, Gupta A. Optimized hybrid machine learning approach for smartphone based diabetic retinopathy detection. Multimed Tools Appl 2022;81(10):14475-14501. https://doi.org/10.1007/s11042- 022-12103-y. Epub 2022 Feb 25. PMID: 35233182; PMCID: PMC8876080.
18. Li HY, Wang DX, Dong L, Wei WB. Deep learning algorithms for detection of diabetic macular edema in OCT images: A systematic review and meta-analysis. Eur J Ophthalmol 2022 Apr 27:11206721221094786. https://doi.org/10.1177/11206721221094786. Epub ahead of print. PMID: 35473414.





































