В контексте пациент-центрированного здравоохранения ключевая роль отводится возможности доступа пациентов к медицинским услугам и связанным со здоровьем данным посредством информационно-телекоммуникационных технологий [1]. В результате стремительного технологического прогресса в последние 5-10 лет на первое место вышли именно мобильные решения, благодаря чему в медицине сформировалось отдельное направление – мобильное здравоохранение (mHealth) [2-5]. Самостоятельным направлением стали так называемые носимые устройства: под этим термином обычно понимаются портативные персональные электронные приборы (реализованные в виде аксессуаров, одежды, украшений или элементов мобильных средств связи), способные интерактивно взаимодействовать с окружающей средой и пользователем. В медицине носимые устройства, как правило, предназначены для фиксации, накопления и отправки в базы данных определенных видов информации, связанной со здоровьем. Практически ежедневно публикуются сообщения о разработке новых видов и классов носимых устройств для медицины и здорового образа жизни.
Тем не менее, целесообразность применения носимых устройств в практической медицине остается практически неизученной.
В связи с этим, была сформулирована цель – систематизировать эффективность и значимость использования носимых устройств в практическом здравоохранении.
ДИЗАЙН ИССЛЕДОВАНИЯ
Систематический обзор литературы, посвященный клинической методологии и эффективности применения носимых устройств в медицине был проведен нами на основе рекомендаций «The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions» [45].
Стратегия поиска приведена на рис.1. Поиск публикаций был проведен двумя авторами независимо в базах данных Научной электронной библиотеки (www.elibrary.ru) и Национальной медицинской библиотеки «Pubmed» (www.pubmed.org.). Языковых и иных ограничений не было (публикации на языках кроме русского и английского включали в базу при наличии достаточных данных в реферате). Поиск проводился на двух языках (русском и английском). Для формулировки англоязычных терминов для поиска были использованы медицинские предметные заголовки (Medical Subject Headings – MeSH), сформированы такие поисковые запросы: wearable[All Fields] AND ("health"[MeSH Terms] OR "health"[All Fields]) AND ("medicine"[MeSH Terms] OR "medicine"[All Fields]). Для поиска русскоязычных публикаций использованы такие поисковые запросы: («носимые технологии» ИЛИ «носимые устройства») И («медицина» И «здоровье» И «здравоохранение»).
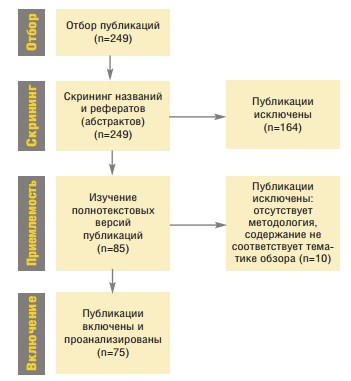
Рис. 1. Стратегия отбора публикаций для систематического обзора
Были проанализированы все рефераты статей, полученные в ходе поиска. Релевантные статьи были отобраны для детального изучения.
Критерии включения публикации:
1. Четкое соответствие теме разработки клинической методологии и доказательного изучения эффективности использования носимых технологий в практическом здравоохранении.
2. Оригинальное исследование.
3. Публикация в рецензируемом журнале или в сборниках статей международных научных конференций.
4. Приведены способы применения определенных видов носимых устройств в лечебно-диагностических процессах.
5. Приведены объективные данные о диагностической ценности носимых устройств в сравнении с «золотым стандартом».
6. Приведены объективные данные о влиянии систематического использования носимых устройств на параметры жизнедеятельности, показатели работы медицинских организаций
Результаты поиска были актуальны по состоянию на 01.12.2015. Все первично отобранные публикации были вынесены на коллективное обсуждение для устранения спорных моментов и создания консенсуса по окончательной базе данных для исследования.
Все публикации, включенные в базу, были получены в полнотекстовом виде (из открытых источников, в результате приобретения разовой подписки или путем личного контакта с автором). Полные тексты статей распределяли согласно Оксфордской классификации уровней достоверности [36]. Затем из каждой публикации были отобраны следующие данные: имя автора, год публикации, страна, цель, дизайн исследования, проверка статистической гипотезы, описание методики клинического использования, результат оценки эффективности, общие результаты
Полученные данные были систематизированы и проанализированы.
НОСИМЫЕ УСТРОЙСТВА В МЕДИЦИНЕ – ОБЩАЯ ХАРАКТЕРИСТИКА
Мы обобщили данные об оценке эффективности различных видов и классов носимых устройств в практическом здравоохранении. Сведения о дизайнах исследований приведены в таблице 1.
Таблица 1. Сводные данные о дизайнах научных исследований в сфере методологии и эффективности применения носимых устройств в медицине
| Дизайн исследования | Удельный вес |
|---|---|
| Обсервационное одномоментное | 4.0% (3) |
| Проспективное рандомизированное клиническое испытание | 4.0% (3) |
| Технико-экономическое обоснование и оценка используемости | 8.0% (6) |
| Когортное | 11.0% (8) |
| Диагностическое | 12.0% (9) |
| Одномоментное (кросс-секционные) | 12.0% (9) |
| Экспериментальное (клиническое) | 49.0% (36) |
Как следует из приведенных данных (табл.1), общий уровень доказательности исследований в сфере клинической методологии и эффективности применения носимых устройств в медицине является низким. Удельный вес проспективных рандомизированных клинических испытаний составляет всего 4,0%, диагностических – только 12,0%. Практически половина всех научных исследований проводится в формате клинического эксперимента.
Общеметодические вопросы использования носимых устройств в медицине остаются практически не сформулированными. Чуть ли не единственным исключением является попытка систематизировать средства для трекинга физической активности (табл. 2)
Таблица 2. Классификация носимых датчиков для оценки двигательной активности по B.H. Dobkin, 2013 [20]
| Сенсор | Параметр |
|---|---|
| Трехосный акселерометр | Акселерация/децелерация. скорость и смещение сегмента тела в осях х. у. 2 |
| Гироскоп | Угловая скорость и ротация |
| Глобальное позиционирование (GPS) | Локализация вне помещений, расчет скорости и преодоленной дистанции при помощи мобильного приложения |
| Магнитометр | Векторы направлений для ориентации в пространстве |
| Электромиография | Сухие электроды для регистрации с поверхности тела времени и количества сокращений определенных групп мышц |
| Гониометр | Объем движений в суставах |
| Датчики давления и сгибания | Оптоволокно или «умная» ткань вокруг суставов для определения объема движений: пъезоэлектроды для определения распределения веса (в обуви) для мониторинга ходьбы и осанки |
| Окружающая среда | Окружающий свет. звук, активируемые при движениях фото и видеозапись |
Приведенная классификация является предварительной, неполной, требующей дальнейшей тщательной доработки.
J.A.Slade Shantz с соавт. полагают, что существуют три варианта применения носимых устройств в хирургии и выделяют при этом три вида технологических решений: «многослойные», «параллельные» и «прорывные» [70] (табл. 3).
Таблица 3. Варианты использования носимых технологий в хирургии по J.A.Slade Shantz et al, 2014 [70]
|
«Многослойная» технология |
«Параллельная» технология | «Прорывная» технология |
|---|---|---|
| • «Умные очки» как дисплей радиологической информационной системы | • Трекеры активности фиксируют снижение мобильности при сосудистой патологии | • Прогноз прогрессирования болезни до появления симптомов на основе биометрических данных |
| • Датчики осанки для контроля высоты стола и работы хирурга | • Трекеры сна фиксируют улучшение периодов отдыха после хирургического лечения плечевого сустава |
Приведенную схему можно считать ориентировочной, положительной ее стороной является специализация (то есть ориентированность на конкретную клиническую дисциплину и определенные лечебно-диагностические задачи); тем не менее схема является неполной
Материалы таблиц 2 и 3 могут быть взяты за основу при комплексной, углубленной разработке методических основ применения носимых устройств в здравоохранении.
В настоящее время существует большое количество носимых устройств, которые прямо или косвенно могут использоваться в целях здравоохранения (рис. 2).
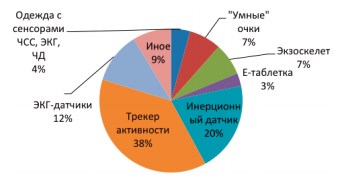
Рис. 2. Удельный вес различных типов и видов носимых устройств, применяемых исследователями методологии и эффективности их применения в медицине
В большинстве исследований (38,0%) фигурировали различные трекеры активности в виде браслетов, клипс, а также – комбинации встроенных датчиков смартфонов с мобильными приложениями. Вторыми по частоте используемости были носимые устройства с инерционными датчиками – 20,0%; обычно они также реализовывались в виде браслетов или клипс. Третье место занимают датчики электрокардиосигнала (12,0%), реализованные как в виде классических электродов, так и в виде пластыря. Сведения о частоте используемости иных типов носимых устройств приведены на диаграмме (рис.1). Дополнительно укажем, что к категории «Иное» (9,0%) отнесли аксессуары с RFID-метками или ультразвуковыми радарами, датчики кожно-гальванических реакций, стелька с датчиками давления и GPSмодулем, миникомпьютер со встроенной камерой и «тревожной» кнопкой и т.д. [11,51,72]. Отметим, что использование таких устройств в настоящее время еще не носит системного характера, а в публикациях освещается лишь вопрос используемости (реже – технико-экономического обоснования).
Носимые устройства используются в различных сферах практического здравоохранения (табл.2).
Как следует из табл. 2, наиболее распространенной сферой применения носимых устройств является длительный трекинг показателей физической активности (количество шагов, потраченных калорий, длительность периодов различных видов деятельности, частота пульса) и питания (индекс массы тела, количество полученных калорий, частота и длительность приемов пищи и т.д.) – 30,7% исследований посвящено этой теме.
В сфере неврологии и психиатрии 69,2% исследований посвящены проблеме болезни (синдрома) Паркинсона
В сфере внутренних болезней (рис.3) половина исследователей фокусируются на патологии сердечно-сосудистой системы (этому направлению посвящено ровно 50,0% публикаций). Фактически отдельным направлением является применение носимых устройств в гериатрии (25,0% научных работ).
Для систематизации результатов научных исследований мы приняли решение придерживаться «технологического» подхода, то есть рассматривать отдельные виды носимых устройств применительно к сфере здравоохранения.
«УМНЫЕ» ОЧКИ
Различные модели «умных» очков применяются, преимущественно, в образовательных целях. Опубликован успешный опыт дистанционного обучения в хирургии (на международном уровне) с передачей изображения операционного поля , фиксируемого посредством «GoogleGlass», в процессе герниопластики [19]
«Умные» очки представляют собой интересный инструмент контроля в профессиональном образовании. Так при обучении медицинских сестер проводится запись выполнения процедур с последующим анализом и разбором [55].
Носимые устройства в виде очков могут обеспечить реализацию дополненной реальности в медицине. В настоящее время есть первые результаты подобных разработок для решения как диагностических, так и лечебных задач.
Исследована возможность применения «GoogleGlass» для предоставления врачам доступа к диагностической визуализации во время выполнения инвазивных манипуляций. Рассматривался процесс центрального венозного доступа под ультразвуковым контролем. Сонографическое изображение транслировалось на стандартный монитор или передавалось на дисплей «умных» очков. Фиксировались повороты головы врача, число введений иглы, а также – проводилась хронометрия. Применение медицинской дополненной реальности посредством носимого устройства снизило количество дополнительных движений (поворотов головы), но привело к увеличению длительности процедуры и увеличению количества повторных введений иглы [82].
«GoogleGlass» рассматриваются в контексте дополненной реальности для клинической лабораторной диагностики. Применение специального программного обеспечения и «умных» очков обеспечивает более эффективную качественную и количественную оценку результатов иммунохроматографических экспересс-тестов (на ВИЧ, ПСА). Также обеспечивается автоматическая передача данных в медицинскую информационную систему [25].
По данным анкетирования, «умные» очки потенциально являются ассистирующей технологией для лиц, страдающих болезнью Паркинсона; однако эффективность и такого подхода пока что не доказана [81]. Более того, в последнее время наметилась тенденция по «сворачиванию» проектов, связанных с разработкой «умных» очков. В связи с чем перспективы данного вида носимых устройств в практическом здравоохранении вызывают сомнения.
«УМНАЯ» ОДЕЖДА И ЦИФРОВОЙ ПЛАСТЫРЬ
В нескольких научных публикациях приведены сведения о телемониторинге физических параметров (как правило, электрокардиосигнал (ЭКС) и частоты пульса) с помощью датчиков, интегрированных в предметы одежды, или представляющих собой, так называемый, цифровой пластырь. Большинство работ носит экспериментальный характер с минимальными сведениями об эффективности данного класса носимых устройств [37]. Исключения составляют следующие достижения.
«Умная» одежда: определены требования к оптимальному размещению датчиков ЭКС [16]; показано, что мониторинг амбулаторных пациентов, находящихся на гемодиализе, потенциально повышает качество жизни и снижает риски за счет раннего выявления угрозы осложнений [43].
Доказана потенциальная возможность детекции (скрининга) латентных периодов фибрилляции предсердий у пациентов с повышенным риском с помощью цифрового пластыря [75]. Чувствительность фиксации R-зубцов датчиками цифрвого пластыря достигает 99,3%, а позитивная прогностическая ценность составляет 100,0% [44].
В целом, показатели диагностической ценности при измерении 1или 3-х канальной электрокардиограммы носимыми устройствами соответствуют «золотому стандарту» [35,47,54], что свидетельствует о пригодности данного класса устройств к использованию для телемониторинга на амбулаторном этапе.
ЭКЗОСКЕЛЕТ
В определенном смысле экзоскелет также является носимым устройством. Работы по разработке и совершенствованию данного оборудования ведутся многими коллективами по всему миру. Однако, системных публикаций, освещающих методологию и эффективность их применения нет. Практически декларативно утверждается, что применение экзоскелетов на этапе реабилитации пациентов неврологического и ортопедического профилей сокращает сроки восстановительного лечения, улучшает биомеханические показатели, достоверно снижает удельный вес осложнений (неожиданных смен осанки) по окончании курса (у пациентов с параплегией) [12,34,41-42,73].Однако, все перечисленные результаты получены на малых выборках (обычно n<10) и приводятся в исследованиях с крайне низким уровнем доказательности.
ЦИФРОВАЯ ТАБЛЕТКА
По сравнению с другими видами носимых устройств система под названием «цифровая таблетка» применяется редко, тем не менее ее эффективность изучена гораздо лучше.
С учетом относительно малой известности данной технологии приведем ее короткое описание. Система состоит из:
- дигестивного сенсора (микросхемы, способной передать короткий радиосигнал (сигнатуру) и помещаемой внутрь таблетированного фармакологического препарата),
- нательного сенсора (приемно-передающего устройства, закрепляемого на теле пациента с помощью пластыря),
- смартфона пациента и специального мобильного приложения,
- центральной базы данных с возможностью доступа к ней со стороны медицинских работников (веб-интерфейс).
При приеме медикамента перорально дигестивный сенсор передает сигнатуру, после чего растворяется в желудочном соке и выводится из организма. Нательный сенсор улавливает сигнал и ретранслирует его в мобильное приложение. Отдельной функцией является напоминание о необходимости принять медикамент. Данные о выполнении медикаментозной терапии передаются в медицинское учреждение, где накапливаются в базе данных и анализируются медицинскими работниками. Такой подход повышает приверженность пациентов к лечению и обеспечивает индивидуализированный подход к терапии.
Позитивный опыт использования цифровых таблеток зафиксирован в психиатрии и фтизиатрии. Доказано, что применение данного типа носимых устройств достоверно улучшало своевременность и регулярность приема медикаментов у пациентов с шизофренией и биполярными расстройствами (прием фармпрепарата в течение 2 часов от предписанного времени в основной группе осуществлялся 74,0% (95% ДИ – 64,0%86,0%) пациентами, а в контрольной – 67,0% (95% ДИ 55,0%-79,0%). Дополнительно отметим, что 89,0% пациентов сочли эту технологию весьма полезной [39].
Цифровые таблетки повышают приверженность к медикаментозной терапии и пациентов с туберкулезом, находящихся на амбулаторном лечении. При этом представлены такие показатели диагностической ценности распознавания сигнатур: точность – 95,0-100,0%, специфичность – 99,7% (95% ДИ 99,2-99,9%). Также достоверно показано, что индекс массы тела не влияет на эффективность использования цифровых таблеток [10].
ТРЕКЕРЫ АКТИВНОСТИ
Мониторинг (отслеживание) или трекинг физической активности является, в настоящее время, одной из самых распространенных форм применения носимых устройств
Ключевым вопросом является сопоставимость диагностической информации, получаемой с помощью носимых устройств и посредством стандартных валидизированных методик. Количество диагностических исследований на эту тему остается крайне малым. Среди наиболее доказательных работ следует отметить следующую. Проводилось сравнение трекеров и «золотого стандарта» – прямой калориметрии. В полученных двумя методами значениях нет статистической разницы. Выявлены достоверно высокие показатели положительной прогностической ценности (46,0-77,0%) определения уровня физической активности. Дана общая положительная оценка непрямой калориметрии с помощью носимых устройств как метода исследования (в частности, у детей дошкольного возраста) [6]. Статистически значимое совпадение результатов измерений энергетических затрат некоторыми носимыми устройствами и методом непрямой калориметрии подтверждается и другими авторами [7,57]. Таким образом, для отдельных видов носимых устройств диагностическая ценность подсчета энергетических затрат приемлема для использования в практической медицине. Тем не менее, для этого метода есть и определенные ограничения (о чем мы скажем далее).
Существует два принципиально различных вида решений для трекинга:
- специальные приборы – фитнесс-трекеры (реализуются в виде браслетов, клипс или иных аксессуаров, имеют возможность передавать данные на мобильные устройства (смартфоны, планшетные компьютеры), в личный кабинет, социальные сети),
- смартфоны со встроенными акселерометрами и гироскопами в сочетании со специальными мобильными приложениями.
Выбор конкретного решения обычно осуществляется на субъективной основе (личные предпочтения пользователей). Однако, для системного использования трекинга в здравоохранении следует учитывать результаты объективных сравнений различных типов и видов устройств [13,23,26,48,65].
Проведено сопоставление результатов подсчета количества шагов с помощью 6 носимых устройств (браслетов и клипс), мобильных приложений для смартфонов с операционной системы iOS (n=3) и Android (n=1). «Золотым стандартом» был параллельный очный подсчет количества шагов наблюдателем-человеком. Зафиксированы следующие диапазоны расхождений в измерениях (внутри отдельных видов приборов): клипсы от -0,3 до 1,0%; браслеты от −22,7 до −1,5%; смартфоны и приложения от −6,7 до 6,2% [13]. Показано, что погрешность измерений количества шагов носимыми устройствами может достигать 23,0-29,9% [13,65]. А наиболее корректный подсчет в сравнении с «золотым стандартом» осуществляется смартфонами со специальными мобильными приложениями (операционная система роли не играет) [13]. Подсчет количества шагов осуществляется, по-сути, аппаратными средствами. В то время как расчет иных параметров (калории и т.д.) осуществляется программными на базе математических моделей. И здесь сразу выявляется «слабая» сторона носимых устройств – точность измерений/вычислений снижается, уровень ошибок и расхождений растет [26]. Проведенное сравнительное изучение 9 трекеров показало следующие расхождения результатов измерений: длительность сна – 8,1-16,9%, «сидячий образ жизни» – 9,5-65,8%, низкий уровень физической активности – 19,7-28,0%, средний и высокий уровень физической активности – 51,8-92,0%. Авторы данной работы полагают, что выявленные погрешности слишком велики [65]. В иных публикациях оценки более лояльные – конкордантность измерений различными носимыми устройствами наиболее высока для количества шагов и длительности сна, средние ее показатели фиксируются для оценок физической активность и потраченных калорий [13]. Исходя из вышесказанного, можно констатировать, что в практическом здравоохранении целесообразно использовать параметры активности, определяемые сугубо аппаратными средствами носимых устройств. Диагностическая ценность вычисляемых показателей должна быть доказана для каждой математической модели и соответствующей группы приборов отдельно, в специальных исследованиях.
В настоящее время трекинг физической активности в сфере здравоохранения наиболее часто применяется:
- в период амбулаторного и/или реабилитационного лечения,
- как инструмент научных исследований (физиология, патологическая физиология, спортивная медицина)
Снижение приверженности пациента к трекингу активности в первый месяц после выписки на амбулаторное лечение может косвенно свидетельствовать о риске осложнений, ухудшение общего состояния и угрозе повторной госпитализации [66].
Наметился переход от демонстрации принципиальной возможности использования трекеров активности в практической медицине к разработке методик. В частности, в реабилитации пациентов нейрохирургического профиля проводился подсчет количества шагов с помощью носимых устройств для мониторинга прогресса лечения. Параллельно два независимых эксперта верифицировали результаты измерений с помощью ручных счетчиков-шагомеров. Трекеры в виде клипс были признаны пригодными для контроля успешности восстановительной терапии, при этом достоверно выше точность подсчета шагов фиксируется при размещении клипс в области голеностопного сустава (в сравнении с бедром). Важно отметить, что длина шага пациента является достоверным предиктором точности трекинга [8].
Эффективность (в том числе – клиническая) трекинга физической активности продемонстрирована в единичных исследованиях [63], ее доказательность пока что слаба. Утверждается, что после месяца регулярного использования трекеров на амбулаторном этапе у пациентов с хроническими обструктивными бронхо-легочными заболеваниями отмечается увеличение показателей физической активности, а также повышается субъективная оценка качества жизни [14]. В рандомизированном исследовании показано, что применение групповой психотерапии в сочетании с трекингом активности носимыми устройствами обеспечивает достоверное и выраженное снижение веса в группе пациентов в возрасте 46,8 ± 10,8 лет, страдающих избыточной массой тела. Достоверно продемонстрировано, что применение психотерапии или трекинга отдельно не приводит к столь позитивным результатам [69]. Таким образом, исключительно трекинг не приводит к значимым улучшениям показателей жизнедеятельности, он должен дополняться некими средствами влияния на пациента – программами психотерапии, информирования и обучения (например, посредством систематической рассылки тематических СМС-сообщений) [52].
Наибольшим достижением в сфере трекинга считаем следующее.
Комбинированное применения трекеров активности и иных видов носимых устройств привело к формированию нового метода обследования – ситуационной оценке активности. На ее основе становится возможным сформировать действительно индивидуальные рекомендации и планы лечения, действительно перейти к реализации пациент-центрированного здравоохранения на практике. Комплекс оборудования (трекер активности, носимая портативная видеокамера, датчик географического позиционирования (GPS)) применялся у взрослых и детей с кардиометаболическими рисками, выраженной гиподинамией. Сопоставление показателей активности, местонахождения человека в тот или иной период дня, а также видов деятельности, совершаемых при этом, позволяло четко выявить периоды, усиливающие связанные со здоровьем риски. Таким образом выполняется не просто трекинг, но маппирование физической активности в разные временные периоды. Становится возможным разработать действительно индивидуальные планы лечения, тренировок, профилактических мероприятий, направленные на минимизацию негативного влияния «проблемных точек» – длительных эпизодов бездействия, сидячего положения и т.д. [21,77]. В данном случае можно говорить о профессиональном врачебном анализе и контроле физической активности посредством носимых устройств.
Известны попытки использовать носимые портативные камеры для оценки образа жизни (с позиций контроля массы тела человека). Получаемый видеоряд позволяет [15,29]:
- оценивать влияние окружающих и социальных факторов на поведение в отношении питания;
- проводить подсчет калорий, осуществлять контроль диеты (при диабете или в периоды интенсивных занятий фитнессом), при этом используется специальное программное обеспечение для распознания изображений продуктов питания.
Однако, исключительно видеофиксация (или сугубо маппирование с трекингом [38,79]) не является столь же эффективной, как комплексное использование нескольких приборов одновременно.
Несмотря на свою потенциально высокую эффективность метод маппирования и оценки ситуационной активности имеет ярко выраженные ограничения, связанные с резким ограничением конфиденциальности личной жизни пациента (во всяком случае в определенные периоды амбулаторного лечения). Тем не менее, можно с уверенностью говорить о формировании конкретной методики клинического обследования в рамках модели пациент-центрированного здравоохранения.
Стремительное нарастание количества устройств для трекинга активности сочетается с довольно низкой приверженностью пользователей к их применению. По данным целого ряда публикаций и докладов на научно-практических конференциях средняя длительность использования носимых трекеров активности составляет 6 месяцев. Причиной сложившейся ситуации мы полагаем бесполезность массива накапливаемых данных для пользователя в долгосрочной перспективе. С другой стороны результаты круглосуточного, длящегося месяцами мониторинга активности (количества шагов, потраченных калорий, длительности сна и бодрствования и т.д.), как ни парадоксально, совершенно не воспринимаются врачами в качестве ценной информации о пациенте. Явно назрела необходимость разработки неких инструментов для обработки накапливаемых массивов, выявления неких трендов и закономерностей, валидных для медицинских работников с точки зрения оценки состояния человека, прогнозирования и профилактики, коррекции образа жизни или даже терапевтических программ. Сказанное подтверждается публикациями, которые вышли из печати в последние годы. Эти работы посвящены разработке методов математического анализа больших массивов данных, накапливаемых в процессе трекинга. В результате должны появиться алгоритмы определения валидных, с точки зрения медицины, закономерностей, а также – математически обоснованные предикторы осложнений (у лиц с хронической патологией), падений (в неврологии и гериатрии) [28,49,62]. Один из таких методов обеспечивает прогнозирование рисков падений, ведущих к характерным травмам и тяжелым последствиям, у лиц пожилого и старческого возраста (в том числе, страдающих деменцией) на основе данных дневного трекинга физической актвности [58,67-68].
Примечательно, что некоторые исследователи предлагают математические методы даже для реальновременной оценки поступающих результатов трекинга, что в перспективе является интересным дополнениям к традиционным системам домашней (индивидуальной) телемедицины и телемониторинга [17,80].
Носимые трекеры физической активности используются в комбинации с инерционными датчиками, а также – в качестве инструмента научных исследований; более детально эти вопросы мы осветим далее.
ИНЕРЦИОННЫЕ ДАТЧИКИ
Носимые инерционные датчики (в виде клипс, браслетов и т.д.) обеспечивают измерение амплитуды движений в крупных и мелких суставах, а также ряда смежных параметров, характеристик позы и т.д. [22,47]. Тем не менее, необходимо отметить, что верификации диагностической ценности измерений, выполняемых с помощью данного вида устройств фактически нет.
Носимые инерционные датчики используются у целевых групп пациентов для телемониторинга на амбулаторном этапе лечения или в процессе реабилитации (в том числе, в госпитальных условиях)
Показано достоверное улучшение биомеханических показателей при реабилитации у пациентов с периферической диабетической нейропатией [32]. Потенциально интересным методом является определение зависимости характеристик двигательной активности нижних конечностей новорожденного ребенка и сроков начала самостоятельной ходьбы, что может обеспечивать профилактику и раннюю терапию. Однако, клинико-диагностическое обоснование метода в настоящее время не проведено [71].
Особо интенсивно формируются методы применения инерционных датчиков для такой целевой группы, как пациенты, страдающие болезнью Паркинсона [30,40,78]. Эффективен с позиций используемости и оценки пользователями домашний телемониторинг симптомов указанного патологического состояния (тремора, гипои дискинезий и т.д.) [27]. Доказано, что с помощью носимых устройств можно определять тип и характеристики тремора, проводить дифференциальную диагностику тремора и иных двигательных расстройств; а диагностическая точность «отделения» тремора от обычной активности составляет 87,0% [64].
Сочетание носимых инерционных датчиков с иными диагностическими приборами, датчиками «умного дома», веб-технологиями, видеоконференциями обеспечивают наиболее эффективный контроль и управление пациентом, профилактику осложнений, падений, а также – оказание своевременной медицинской помощи [31,59-60]. Комплексное использование инерционных датчиков и трекеров активности потенциально является интересным инструментом клинического исследования и телемониторинга; в частности – у пациентов, страдающих болезнью Паркинсона зафиксированы положительная оценка пользователей, подтверждена идентичность диагностической ценности для бытовых и госпитальных условий [74-75]. Данная комбинация носимых устройств позволяет эффективно выявлять осложнения в виде нарушений дыхания (в том числе, апноэ во сне) у пациентов, выписанных на амбулаторное лечение после хирургического вмешательства. Точность определения нарушений дыхания составляет 98,0%, что верифицировано данными спирометрии [24]. В гериатрии становится возможной комплексная оценка параметров походки, баланса и активности пациента для классификации и прогнозирования рисков связанных с падениями [68].
Можно констатировать факт, что носимые трекеры активности, инерционные и иные датчики (например, кожно-гальванических реакций, электромиографические) стали новым поколением устройств – инструментов динамической биотелеметрии [7, 33]. Посредством трекинга изучаются зависимости между уровнем физической активности и динамикой колебаний артериального давления [49-50], осуществляется прогнозирование степени стресса по вариабельности сердечного ритма в процессе трудовой деятельности [56]. Инерционные датчики применяются для оценки биомеханических показателей в ортопедии [9,53], спортивной медицине [18]. В контексте динамической биотелеметрии носимые устройства являются удобным и достаточно точным инструментом получения новых данных.
ВЫВОДЫ
Наметилась тенденция перехода от деклараций к научному обоснованию целесообразности, диагностической ценности и методологии применения различных классов носимых устройств в клинической медицине
В целом доказательная база остается слабой: удельный вес проспективных рандомизированных клинических испытаний составляет всего 4,0%, диагностических – только 12,0%
В настоящее время существует большое количество носимых устройств, которые прямо или косвенно могут использоваться в целях здравоохранения. В большинстве исследований случаев это трекеры активности (38,0%), носимые устройства с инерционными датчиками (20,0%), датчики электрокардиосигнала (12,0%).
Носимые устройства используются в различных сферах практического здравоохранения, но наиболее часто для трекинга в области профилактической медицины и нутрициологии (30,7%), в психиатрии и неврологии (17,3%), для диагностики и лечения внутренних болезней (16,0%), а также – в реабилитации (13,3%).
Трекинг (мониторинг) физической активности является одной из самых распространенных форм применения носимых устройств. Приведены достоверно высокие показатели положительной прогностической ценности (46,0-77,0%) определения уровня физической активности с помощью трекеров в сравнении с прямой и непрямой калориметрией.
Конкордантность измерений показателей физической активности различными носимыми устройствами наиболее высока для количества шагов и длительности сна, средние ее показатели фиксируются для оценок физической активность и потраченных калорий. В практическом здравоохранении целесообразно использовать параметры активности, определяемые аппаратными средствами носимых устройств.
Демонстрация принципиальной возможности использования носимых устройств в практической медицине сменяется обоснованием и изучением конкретных методов для реабилитации, борьбы с ожирением, контроля болезни Паркинсона, предикции осложнений и т.д.
Комбинированное применение носимых устройств обусловило формирование нового метода обследования – ситуационной оценки активности. На ее основе становится возможным сформировать индивидуальные рекомендации и планы лечения, перейти к реализации пациент-центрированного здравоохранения на практике.
Назрела необходимость разработки инструментов обработки накапливаемых в результате трекинга массивов информации, выявления трендов и закономерностей, валидных для медицинских работников с точки зрения оценки состояния человека, прогнозирования и профилактики, коррекции образа жизни или даже терапевтических программ
Приведенные сведения о эффективности и диагностической ценности не могут быть механически масштабированы на все модели носимых устройств в пределах определенного класса (например, на все датчики ЭКС или фитнесстрекеры). Доказана принципиальная возможность применения отдельных классов носимых устройств в практическом здравоохранении. Но каждая новая модель или разновидность должна проходить клинические испытания и сравнение диагностической ценности с «золотым стандартом»
Четко виден дисбаланс между «техническими» и «медицинскими» аспектами носимых устройств. Практически ежедневно публикуются сведения о разработке новых видов и классов приборов, но научных исследований их клинической значимости практически не проводится. Исходя из вышесказанного утверждаем, что, несмотря на достигнутые вполне серьезные результаты, методологические вопросы использования носимых устройств в практической медицине требуют дальнейшей разработки
ЛИТЕРАТУРА
1. Кузнецов П.П., Владзимирский А.В.Виртуальный госпиталь - инновационная платформа предоставления медицинских услуг//Здравоохранение: журнал рабочих ситуаций главного врача. - М.,2015.-N5.-C.66-72
2. Кузнецов П.П. Перспективы развития мобильной медицины в России//Журнал главного врача.-№2.-2015.-Ñ.14-25.
3. Кузнецов П.П., Шелехов П.В. Мобильная медицина: игтеграция данных с приложений и устройств mHealth и loT (обзор)//Информационно-измерительные и управляющие системы.-2015.-Ò.13,-№10.-Ñ.33-56.
4. Цветкова Л.А., Кузнецов П.П., Куракова Н.Г. Оценка перспектив развития мобильной медицины mHealth на основании данных наукометрического и патентного анализа// Врач и информационные технологии.-2014.-№4.-Ñ.66-77.
5. Шадеркин И.А., Цой А.А., Сивков А.В., Шадеркина В.А., Просянников М.Ю., Войтко Д.А., Зеленский М.М. mHealth новые возможности развития телекоммуникационных технологий в здравоохранении // Экспериментальная и клиническая урология..-2015.-№2.-Ñ.142-148.
6. Adolph AL, Puyau MR, Vohra FA et al. Validation of uniaxial and triaxial accelerometers for the assessment of physical activity in preschool children. J Phys Act Health. 2012 Sep;9(7):944-53.
7. Altini M, Penders J, Vullers R, Amft O. Automatic heart rate normalization for accurate energy expenditure estimation. An analysis of activities of daily living and heart rate features. Methods Inf Med. 2014;53(5):382-8.
8. Appelboom G, Taylor BE, Bruce E et al. Mobile Phone-Connected Wearable Motion Sensors to Assess Postoperative Mobilization. JMIR Mhealth Uhealth. 2015 Jul 28;3(3):e78.
9. Arosha Senanayake SM, Ahmed Malik O, Mohammad Iskandar P, Zaheer D. Assessing post-anterior cruciate ligament reconstruction ambulation using wireless wearable integrated sensors. J Med Eng Technol. 2013 Nov;37(8):498-510.
10. Belknap R, Weis S, Brookens A et al. Feasibility of an ingestible sensor-based system for monitoring adherence to tuberculosis therapy. PLoS One. 2013;8(1):e53373.
11. Bhatlawande S, Sunkari A, Mahadevappa M et al. Electronic bracelet and vision-enabled waist-belt for mobility of visually impaired people. Assist Technol. 2014 Winter;26(4):186-95.
12. Byl NN. Mobility training using a bionic knee orthosis in patients in a post-stroke chronic state: a case series. J Med Case Rep. 2012 Jul 23;6:216.
13. Case MA, Burwick HA, Volpp KG, Patel MS. Accuracy of smartphone applications and wearable devices for tracking physical activity data. JAMA. 2015 Feb 10;313(6):625-6.
14. Caulfield B, Kaljo I, Donnelly S. Use of a consumer market activity monitoring and feedback device improves exercise capacity and activity levels in COPD. Conf Proc IEEE Eng Med Biol Soc. 2014 Aug;2014:1765-8.
15. Chen HC, Jia W, Sun X et al. Saliency-aware food image segmentation for personal dietary assessment using a wearable computer. Meas Sci Technol. 2015 Feb;26(2). pii: 025702.
16. Cho H, Lee JH. A Study on the Optimal Positions of ECG Electrodes in a Garment for the Design of ECG-Monitoring Clothing for Male. J Med Syst. 2015 Sep;39(9):279.
17. Clements CM, Buller MJ, Welles AP, Tharion WJ. Real time gait pattern classification from chest worn accelerometry during a loaded road march. Conf Proc IEEE Eng Med Biol Soc. 2012;2012:364-7.
18. Dadashi F, Crettenand F, Millet GP, Aminian K. Front-crawl instantaneous velocity estimation using a wearable inertial measurement unit. Sensors (Basel). 2012 Sep 25;12(10):12927-39.
19. Datta N, MacQueen IT, Schroeder AD et al. Wearable Technology for Global Surgical Teleproctoring. J Surg Educ. 2015 Nov-Dec;72(6):1290-5.
20. Dobkin BH. Wearable motion sensors to continuously measure realworld physical activities. Curr Opin Neurol. 2013 Dec;26(6):602-8.
21. Doherty AR, Kelly P, Kerr J et al. Using wearable cameras to categorise type and context of accelerometer-identified episodes of physical activity. Int J Behav Nutr Phys Act. 2013 Feb 13;10:22.
22. El-Gohary M, McNames J. Shoulder and elbow joint angle tracking with inertial sensors. IEEE Trans Biomed Eng. 2012 Sep;59(9):2635-41.
23. Feito Y, Bassett DR, Tyo B, Thompson DL. Effects of body mass index and tilt angle on output of two wearable activity monitors. Med Sci Sports Exerc. 2011 May;43(5):861-6.
24. Fekr AR, Radecka K, Zilic Z. Design and Evaluation of an Intelligent Remote Tidal Volume Variability Monitoring System in E-Health Applications. IEEE J Biomed Health Inform. 2015 Sep;19(5):1532-48.
25. Feng S, Caire R, Cortazar B, Turan M, Wong A, Ozcan A. Immunochromatographic diagnostic test analysis using Google Glass. ACS Nano. 2014 Mar 25;8(3):3069-79.
26. Ferguson T, Rowlands AV, Olds T, Maher C. The validity of consumerlevel, activity monitors in healthy adults worn in free-living conditions: a cross-sectional study. Int J Behav Nutr Phys Act. 2015 Mar 27;12:42.
27. Ferreira JJ, Godinho C, Santos AT et al. Quantitative home-based assessment of Parkinson s symptoms: the SENSE-PARK feasibility and usability study. BMC Neurol. 2015 Jun 10;15:89.
28. Garcia-Ceja E, Brena RF, Carrasco-Jimenez JC, Garrido L. Long-term activity recognition from wristwatch accelerometer data. Sensors (Basel). 2014 Nov 27;14(12):22500-24.
29. Gemming L, Doherty A, Utter J, Shields E, Ni Mhurchu C. The use of a wearable camera to capture and categorise the environmental and social context of self-identified eating episodes. Appetite. 2015 Sep 1;92:118-25.
30. Giansanti D, Macellari V, Maccioni G. Telemonitoring and telerehabilitation of patients with Parkinson s disease: health technology assessment of a novel wearable step counter. Telemed J E Health. 2008 Jan-Feb;14(1):76-83. 31. Gövercin M, Költzsch Y, Meis M et al. Defining the user requirements for wearable and optical fall prediction and fall detection devices for home use. Inform Health Soc Care. 2010 Sep-Dec;35(3-4):177-87.
32. Grewal GS, Sayeed R, Schwenk M et al. Balance rehabilitation: promoting the role of virtual reality in patients with diabetic peripheral neuropathy. J Am Podiatr Med Assoc. 2013 Nov-Dec;103(6):498-507.
33. Harrington DM, Dowd KP, Bourke AK, Donnelly AE. Cross-sectional analysis of levels and patterns of objectively measured sedentary time in adolescent females. Int J Behav Nutr Phys Act. 2011 Oct 28;8:120.
34. Herrnstadt G, Alavi N, Randhawa BK, Boyd LA, Menon C. Bimanual elbow robotic orthoses: preliminary investigations on an impairment forcefeedback rehabilitation method. Front Hum Neurosci. 2015 Mar 30;9:169.
35. Hong S, Yang Y, Kim S et al. Performance study of the wearable onelead wireless electrocardiographic monitoring system. Telemed J E Health. 2009 Mar;15(2):166-75.
36. Howick J, Chalmers I, Glasziou P et al Explanation of the 2011 Oxford Centre for Evidence-Based Medicine (OCEBM) Levels of Evidence (Background Document).-Oxford Centre for Evidence-Based Medicine.http://www.cebm.net (20.09.2015).
37. Huang A, Xu W, Li Z et al. System light-loading technology for mHealth: Manifold-learning-based medical data cleansing and clinical trials in WECARE Project. IEEE J Biomed Health Inform. 2014 Sep;18(5):1581-9.
38. Jayaraman A, Deeny S, Eisenberg Y, Mathur G, Kuiken T. Global position sensing and step activity as outcome measures of community mobility and social interaction for an individual with a transfemoral amputation due to dysvascular disease. Phys Ther. 2014 Mar;94(3):401-10.
39. Kane JM, Perlis RH, DiCarlo LA et al. First experience with a wireless system incorporating physiologic assessments and direct confirmation of digital tablet ingestions in ambulatory patients with schizophrenia or bipolar disorder. J Clin Psychiatry. 2013 Jun;74(6):e533-40.
40. King LA, Mancini M, Priest K et al. Do clinical scales of balance reflect turning abnormalities in people with Parkinson s disease? J Neurol Phys Ther. 2012 Mar;36(1):25-31.
41. Koyama S, Tanabe S, Saitoh E et al. Characterization of unexpected postural changes during robot-assisted gait training in paraplegic patients. Spinal Cord. 2015 Aug 11. doi: 10.1038/sc.2015.138. [Epub ahead of print]
42. Kubota S, Nakata Y, Eguchi K et al. Feasibility of rehabilitation training with a newly developed wearable robot for patients with limited mobility. Arch Phys Med Rehabil. 2013 Jun;94(6):1080-7.
43. Lacquaniti A, Donato V, Lucisano S, Buemi A, Buemi M. A biotechnological T-shirt monitors the patient s heart during hemodialysis. Ren Fail. 2012;34(6):818-20.
44. Lee WK, Yoon H, Park KS. Smart ECG Monitoring Patch with Builtin R-Peak Detection for Long-Term HRV Analysis. Ann Biomed Eng. 2015 Nov 11. [Epub ahead of print]
45. Liberati A, Altman DG, Tetzlaff J, Mulrow C et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. J Clin Epidemiol. 2009 Oct;62(10):e1-34. doi: 10.1016/j.jclinepi.2009.06.006. Epub 2009 Jul 23.
46. Lin CT, Chang KC, Lin CL et al. An intelligent telecardiology system using a wearable and wireless ECG to detect atrial fibrillation. IEEE Trans Inf Technol Biomed. 2010 May;14(3):726-33.
47. Lin JF, Kulić D. Human pose recovery using wireless inertial measurement units. Physiol Meas. 2012 Dec;33(12):2099-115.
48. Lyden K, Kozey Keadle SL, Staudenmayer JW, Freedson PS. Validity of two wearable monitors to estimate breaks from sedentary time. Med Sci Sports Exerc. 2012 Nov;44(11):2243-52.
49. Marschollek M. A semi-quantitative method to denote generic physical activity phenotypes from long-term accelerometer data--the ATLAS index. PLoS One. 2013 May 8;8(5):e63522.
50. Marschollek M. Physical activity event regularity and health outcome Undiscovered country in cohort accelerometer data. Stud Health Technol Inform. 2015;210:657-9.
51. Mastrandrea R, Soto-Aladro A, Brouqui P, Barrat A. Enhancing the evaluation of pathogen transmission risk in a hospital by merging handhygiene compliance and contact data: a proof-of-concept study. BMC Res Notes. 2015 Sep 10;8(1):426.
52. Martin SS, Feldman DI, Blumenthal RS et al. mActive: A Randomized Clinical Trial of an Automated mHealth Intervention for Physical Activity Promotion. J Am Heart Assoc. 2015 Nov 9;4(11). pii: e002239.
53. Menz HB, Levinger P, Tan JM, Auhl M, Roddy E, Munteanu SE. Rockersole footwear versus prefabricated foot orthoses for the treatment of pain associated with first metatarsophalangeal joint osteoarthritis: study protocol for a randomised trial. BMC Musculoskelet Disord. 2014 Mar 15;15:86.
54. Merilahti J, Pärkkä J, Antila K et al. Compliance and technical feasibility of long-term health monitoring with wearable and ambient technologies. J Telemed Telecare. 2009;15(6):302-9.
55. Metcalfe H, Jonas-Dwyer D, Saunders R, Dugmore H. Using the Technology: Introducing Point of View Video Glasses Into the Simulated Clinical Learning Environment. Comput Inform Nurs. 2015 Oct;33(10):443-7.
56. Muaremi A, Arnrich B, Tröster G. Towards Measuring Stress with Smartphones and Wearable Devices During Workday and Sleep. Bionanoscience. 2013;3:172-183.
57. Munguía-Izquierdo D, Santalla A, Legaz-Arrese A. Evaluation of a wearable body monitoring device during treadmill walking and jogging in patients with fibromyalgia syndrome. Arch Phys Med Rehabil. 2012 Jan;93(1):115-22.
58. Najafi B, Armstrong DG, Mohler J. Novel wearable technology for assessing spontaneous daily physical activity and risk of falling in older adults with diabetes. J Diabetes Sci Technol. 2013 Sep 1;7(5):1147-60.
59. Nocua R, Noury N, Gehin C, Dittmar A, McAdams E. Evaluation of the autonomic nervous system for fall detection. Conf Proc IEEE Eng Med Biol Soc. 2009;2009:3225-8.
60. Patel S, Chen BR, Buckley T et al. Home monitoring of patients with Parkinson s disease via wearable technology and a web-based application. Conf Proc IEEE Eng Med Biol Soc. 2010;2010:4411-4.
61. Perego P1, Moltani A, Fusca M et al. Wearable monitoring systems in pre-term newborns care. Stud Health Technol Inform. 2012;177:203-9.
62. Perriot B, Argod J, Pepin JL, Noury N. Characterization of physical activity in COPD patients: validation of a robust algorithm for actigraphic measurements in living situations. IEEE J Biomed Health Inform. 2014 Jul;18(4):1225-31.
63. Rider BC, Bassett DR, Thompson DL, Steeves EA, Raynor H. Monitoring capabilities of the Omron HJ-720ITC pedometer. Phys Sportsmed. 2014 Feb;42(1):24-9.
64. Rigas G, Tzallas AT, Tsipouras MG et al. Assessment of tremor activity in the Parkinson s disease using a set of wearable sensors. IEEE Trans Inf Technol Biomed. 2012 May;16(3):478-87.
65. Rosenberger ME, Buman MP, Haskell WL, McConnell MV, Carstensen LL. 24 Hours of Sleep, Sedentary Behavior, and Physical Activity with Nine Wearable Devices. Med Sci Sports Exerc. 2015 Oct 17. [Epub ahead of print].
66. Samuel Taylor BE, Robison T, Lo E et al. Remote, Continuous Monitoring of Patient Mobility After Discharge: A Marker for 30-Day Readmission. Neurosurgery. 2015 Aug;62 Suppl 1:215.
67. Schwenk M, Mohler J, Wendel C et al. Wearable sensor-based inhome assessment of gait, balance, and physical activity for discrimination of frailty status: baseline results of the Arizona frailty cohort study. Gerontology. 2015;61(3):258-67.
68. Schwenk M, Hauer K, Zieschang T, Englert S, Mohler J, Najafi B. Sensor-derived physical activity parameters can predict future falls in people with dementia. Gerontology. 2014;60(6):483-92.
69. Shuger SL, Barry VW, Sui X et al. Electronic feedback in a dietand physical activity-based lifestyle intervention for weight loss: a randomized controlled trial. Int J Behav Nutr Phys Act. 2011 May 18;8:41.
70. Slade Shantz JA, Veillette CJ. The application of wearable technology in surgery: ensuring the positive impact of the wearable revolution on surgical patients. Front Surg. 2014 Sep 19;1:39.
71. Smith BA, Trujillo-Priego IA, Lane CJ, Finley JM, Horak FB. Daily Quantity of Infant Leg Movement: Wearable Sensor Algorithm and Relationship to Walking Onset. Sensors (Basel). 2015 Aug 4;15(8):19006-20.
72. Sun M, Burke LE, Baranowski T et al. An exploratory study on a chestworn computer for evaluation of diet, physical activity and lifestyle. J Healthc Eng. 2015;6(1):1-22.
73. Tanabe S, Hirano S, Saitoh E. Wearable Power-Assist Locomotor (WPAL) for supporting upright walking in persons with paraplegia. NeuroRehabilitation. 2013;33(1):99-106.
74. Toosizadeh N, Mohler J, Lei H et al. Motor Performance Assessment in Parkinson s Disease: Association between Objective In-Clinic, Objective In-Home, and Subjective/Semi-Objective Measures. PLoS One. 2015 Apr 24;10(4):e0124763.
75. Turakhia MP, Ullal AJ, Hoang DD et al. Feasibility of extended ambulatory electrocardiogram monitoring to identify silent atrial fibrillation in high-risk patients: the Screening Study for Undiagnosed Atrial Fibrillation (STUDY-AF). Clin Cardiol. 2015 May;38(5):285-92.
76. Tzallas AT, Tsipouras MG, Rigas G et al. PERFORM: a system for monitoring, assessment and management of patients with Parkinson s disease. Sensors (Basel). 2014 Nov 11;14(11):21329-57.
77. Yan K, Tracie B, Marie-Ève M et al. Innovation through Wearable Sensors to Collect Real-Life Data among Pediatric Patients with Cardiometabolic Risk Factors. Int J Pediatr. 2014;2014:328076. doi: 10.1155/2014/328076.
78. Zampieri C, Salarian A, Carlson-Kuhta P, Nutt JG, Horak FB. Assessing mobility at home in people with early Parkinson s disease using an instrumented Timed Up and Go test. Parkinsonism Relat Disord. 2011 May;17(4):277-80.
79. Zhang Z, Poslad S. Design and test of a hybrid foot force sensing and GPS system for richer user mobility activity recognition. Sensors (Basel). 2013 Nov 1;13(11):14918-53.
80. Zhang Y, Beenakker KG, Butala PM et al. Monitoring walking and cycling of middle-aged to older community dwellers using wireless wearable accelerometers. Conf Proc IEEE Eng Med Biol Soc. 2012;2012:158-61.
81. Zhao Y, Heida T, van Wegen EE, Bloem BR, van Wezel RJ. E-health Support in People with Parkinson s Disease with Smart Glasses: A Survey of User Requirements and Expectations in the Netherlands. J Parkinsons 2015;5(2):369-78.
82. Wu TS, Dameff CJ, Tully JL. Ultrasound-guided central venous access using google glass. J Emerg Med. 2014 Dec;47(6):668-75.





































