ВВЕДЕНИЕ
Представленные в большинстве клиник города Москвы методы диагностики отличаются высокой затратностью ресурсов и времени, поэтому в данной работе представлена разработанная блок-схема нового иммуноферментного фотометра, способного анализировать кровь или интерстициальную жидкость (ИСЖ) в разных условиях: в лаборатории, в больнице и в повседневной жизни. Метод фотометрии позволяет сократить время лабораторной диагностики и повысить такие характеристики, как чувствительность и специфичность в исследовании биологических жидкостей. В методике фотометрии будет использован метод ИФА с использованием моноклональных антител. Внедрение большого количества разновидностей моноклональных антител поможет выявить большое количество антигенов в организме человека.
МАТЕРИАЛЫ И МЕТОДЫ
Мониторинг концентрации антигенов в крови человека с помощью датчика непрерывного контроля «SARS-COV-METR» и фотометра является самым перспективным и конкурентоспособным способом контроля жизненных показателей здоровья. Датчик предполагает использование наночастиц и приложения.
Создание простого, недорогого, высокочувствительного и быстрого иммунологического анализа для обнаружения антигенов в ИСЖ человека является эффективным средством выявления ранней инфекции и борьбы с пандемией.
Из-за пандемии в обществе появился ряд проблем:
- На рынке не существует метода диагностики по большинству вирусов и других микробов единовременно.
- ПЦР-тесты не дают стопроцентного результата.
- Анализ по нескольким профилям антигенов.
- В крови не всегда можно найти искомый антиген, даже при его наличии.
- При исследовании крови по нескольким показателям нужно забирать достаточно большой объем крови.
Существует настоятельная необходимость в простой, быстрой, надежной и экономичной системе для количественного определения антигенов, которая будет удобной для пользователей и стационарной для лабораторий (например, фотометр). Эта система будет анализировать образцы жидкости пациента на определенные вирусные группы, используя моноклональные антитела и разные длины световых волн, измеряемых фотометром.
Проект будет взаимодействовать со смартфоном. Возникновение смартфонов и планшетов открыло новые возможности в здравоохранении, предлагая персонализированный подход к медицине и улучшая информированность пациентов, а также управление их состоянием. В настоящее время многие люди регулярно следят за своим здоровьем и покупают дорогие «умные часы» для мониторинга жизненно важных показателей. Учитывая растущий интерес к своему здоровью, можно рассмотреть возможность сотрудничества с крупными производителями «умных часов».
Задачи включают в себя:
- Изучение информации о фотометрах, принципах их работы, интерстициальной жидкости (ИСЖ), ПЦР-тестах, датчиках непрерывного мониторинга глюкозы у пациентов с сахарным диабетом, а также системах обнаружения антител в ИСЖ с использованием биолюминесцентных сенсоров и смартфонов.
- Обсуждение концепции с наставником и сотрудничество с преподавателями университетов.
- Проведение социальных опросов.
- Создание 3D-модели датчика и прототипа приложения.
- Поиск подходящего метода для измерения концентрации антигенов в крови.
- Исследование интерстициальной жидкости (ИСЖ).
- Изучение методов получения ИСЖ.
- Определение организаций и мест, где проект может быть реализован.
- Разработка бизнес-плана для проекта.
- Подведение итогов и формулирование выводов.
ГИПОТЕЗА ИССЛЕДОВАНИЯ. РЕЗУЛЬТАТЫ
Гипотеза исследования заключается в том, что при обработке непрерывных физиологических данных, собранных с помощью носимого устройства, и информации, предоставляемой пациентами, с использованием облачной аналитической платформы можно выявлять физиологические изменения и другие клинически значимые сигналы, указывающие на раннее прогрессирование вирусных и других заболеваний.
Во время пандемии датчик сыграет ключевую роль, отслеживая различные жизненно важные показатели, такие как частота сердечных сокращений, вариабельность сердечного ритма, изменения пульса, частота дыхания в состоянии покоя, активность, количество шагов, температура кожи и другие параметры. С помощью Bluetooth-соединения с приложением на смартфоне данные, полученные носимым устройством, смогут передаваться удаленно в реальном времени. Специально разработанное приложение на смартфоне будет позволять пациентам участвовать в мониторинге своего здоровья, регулярно сообщая о симптомах и узнавая о своих физических и физиологических показателях через интерфейсы.
Пассивные физиологические данные, полученные с устройства, и активные сведения о симптомах и результатах с аналитической платформы будут автоматически загружаться в консоль мониторинга в базе данных. Это позволит использовать платформу для эффективного и удаленного наблюдения за пациентами и оценки прогрессирования заболевания. Устройство пациента, находящегося на карантине, будет также оснащено GPS-датчиком, чтобы предотвратить контакт инфицированного человека со здоровыми.
Наноферментный иммунохроматографический сенсор для быстрого и количественного определения антигенов в крови человека
- Антиген (NP) реагирует с первым специфическим моноклональным антителом в образце крови;
Моноклональные антитела (мАт) представляют собой сложные молекулы с высокой специфичностью и аффинностью, что делает их полезными для новых диагностических и терапевтических целей. Ученые разработали множество общих биологических методов, таких как иммуноферментный анализ, вестерн-блоттинг и проточная цитометрия, основанных на использовании мАт. Помимо лабораторного применения, мАт также показывают большие перспективы в клинической практике для лечения различных заболеваний [1].
Эти антитела производятся идентичными иммунными клетками, являющимися клонами одной уникальной родительской клетки. Моноклональные антитела могут демонстрировать моновалентную аффинность, что означает, что они связываются с одним и тем же эпитопом (участком антигена, распознаваемым антителом). Вместо ожидания, что вакцинации приведут к выработке собственных антител организмом, ученые исследуют варианты этих молекул, способные напрямую уничтожать антигены [2].
В настоящее время моноклональные антитела часто получают путем выделения или трансформации клеток, производящих антитела, из иммунизированных животных или пациентов, а также путем трансплантации генов, отвечающих за антитела, в подходящие клеточные линии.
- Первое моноклональное антитело (mAb1), соединенное с биметаллическими наночастицами из золота и платины, наносится на конъюгированную подушку тестовой полоски, после чего оно мигрирует и связывается со вторым моноклональным антителом (mAb2), зафиксированным на тестовой линии мембраны NC, формируя сложную структуру (Au-PtNPs-mAb1NP-mAb2).
- Раствор субстрата Au-PtNPs-mAb1-NPmAb2 катализируется для цветной реакции.
- Лазер проходит через субстрат и возвращается к фотометру, который измеряет свет, уровень которого обратно пропорционален концентрации антигенов в образце.
- Результаты, полученные фотометром, одновременно передаются на смартфон через Bluetooth-соединение для дальнейшей обработки данных.
С помощью метода микрофлюидики возможно внедрение технологии в «Смарт часы». Микрофлюидика позволяет работать с жидкостью, объем которой обычно находится в диапазоне от нанодо микролитров (10 л) или меньше. Микрофлюидика является ключом к совершенствованию молекулярных сенсоров на основе биотестов, включая иммуноанализ, разделение клеток, амплификацию ДНК и анализ, среди многих других примеров. Системы быстро обрабатывают большое количество параллельных экспериментов с небольшим количеством реагентов и автоматизируют химические, биологические и медицинские приложения в больших масштабах с низкими затратами.
Например, уменьшение размера реакционной камеры в 10 раз увеличивает скорость реакции в 100 раз, поскольку меньшая характерная длина системы уменьшает время диффузии.
В дополнение к более быстрому времени реакции, требуемые количества анализируемого вещества и реагентов также уменьшаются пропорционально уменьшению объема реакционной камеры. Это не только снижает стоимость теста за счет уменьшения необходимого количества химических веществ, но также позволяет проводить больше типов тестов параллельно с тем же размером образца.
Этот метод предназначен не только для выявления белка коронавируса, но и для определения маркеров различных других заболеваний, таких как онкология, ВИЧ, ВПЧ и другие [3-8].
Система работы фотометра
В иммуноферментном анализе наиболее широко применяется фотометрический метод для определения активности ферментов. Для этого используются субстраты, продукты реакции которых представляют собой окрашенные соединения или же цвет самих субстратов изменяется в ходе реакции. Окрашенные вещества поглощают видимый свет с длинами волн от 400 до 700 нм. Поглощение света соответствует закону Бугера-Ламберта-Бера, по которому оптическая плотность раствора в заданном диапазоне пропорциональна концентрации вещества. Для измерения оптической плотности применяется спектрофотометр [9].
1.1. Описание принципа работы прибора
На рисунке 2 изображена функциональная схема иммуноферментного фотометра. В начале процесса работы лазерные диоды последовательно включаются с помощью четрырехканального ЦАПа. После получения посылки на выходе ЦАП формируется сигнал, который сглаживается при помощи фильтров нижних частот. Для включения лазерных диодов требуется различная сила тока, поэтому в схеме стоит управляемый источник тока. Луч света поочередно проходит через пробирки, размещенных на ИФА-планшете. После прохождения через пробирки световой луч достигает фотодиода, который трансформирует полученное излучение в ток.
Далее ток проходит через схему преобразования тока в напряжение. Полученное напряжение повышается при помощи усилителя с программируемым коэффициентом усиления для приведения его к диапазону аналого-цифрового преобразования. Предполагается использовать микроконтроллер GD32F470, он имеет встроенное быстродействующее АЦП, а также поддерживает большое количество интерфейсов. Затем происходит преобразование аналогового сигнала в цифровой сигнал с последующей передачей данных в микроконтроллер. Управление устройством осуществляется при помощи кнопочной панели, подключенной по USB. Через Интерфейс HDMI производится передача данных на монитор, при помощи протокола Ethernet осуществляется передача данных на ПК.
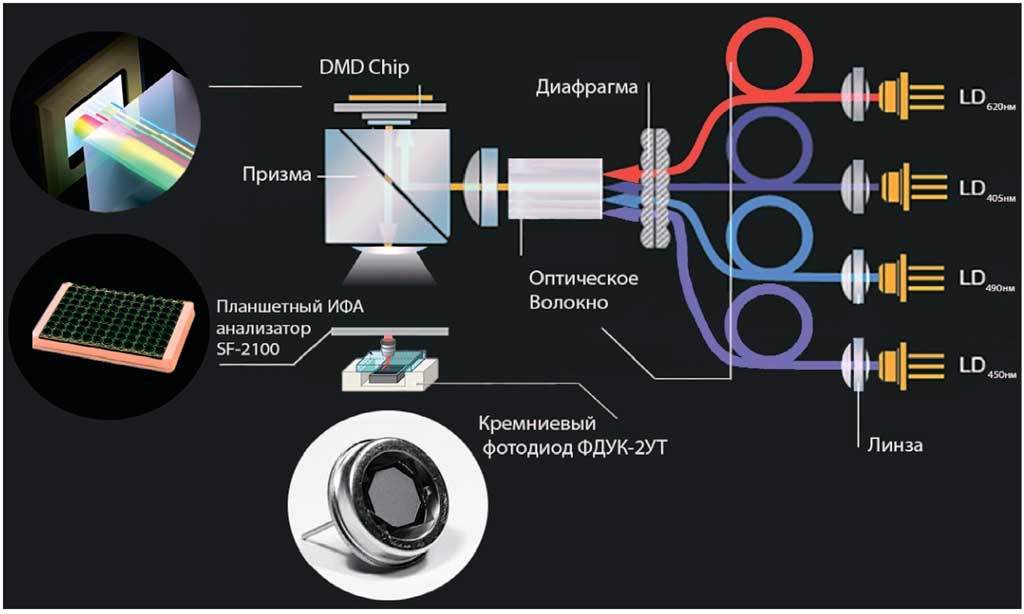
Рис. 1. Схема спектрофотометра
Fig. 1. Diagram of the spectrophotometer
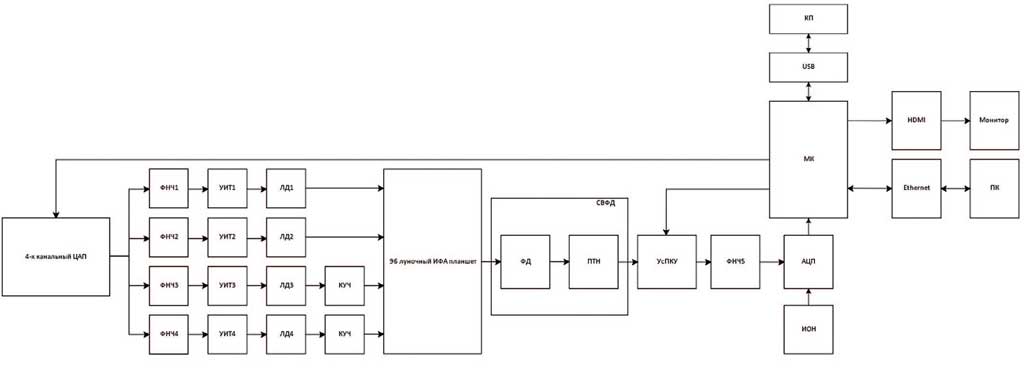
Рис. 2. Функциональная схема прибора
АЦП – Аналого-Цифровой преобразователь; ИОН – Источник опорного напряжения; КП – Кнопочная панель; КУЧ – Кристалл удвоитель частоты; ЛД –Лазерный диод; МК – Микроконтроллер; ПК – Персональный компьютер; ПТН –Преобразователь тока в напряжение; СВФД – Схема включения фотодиода; УИТ –Управляемый источник тока; УсПКУ – Усилитель с программируемым коэффициентом усиления; ФД – Фотодиод; ФНЧ – Фильтр нижних частот; ЦАП – Цифро-аналоговый преобразователь
Fig. 2. Functional diagram of the device
АЦП – Analog-to-Digital Converter; ИОН – Voltage Reference; КП – Pushbutton Panel; КУЧ – Frequency Doubler; ЛД – Laser Diode; МК – Microcontroller; ПК – Personal Computer; ПТН – Current to Voltage Converter; СВФД – Photodiode Circuit; УИТ – Controlled Current Source; УсПКУ – Programmable Gain Amplifier; ФД – Photodiode; ФД – Low Pass Filter; ЦАП – Digital-to-Analog Converter
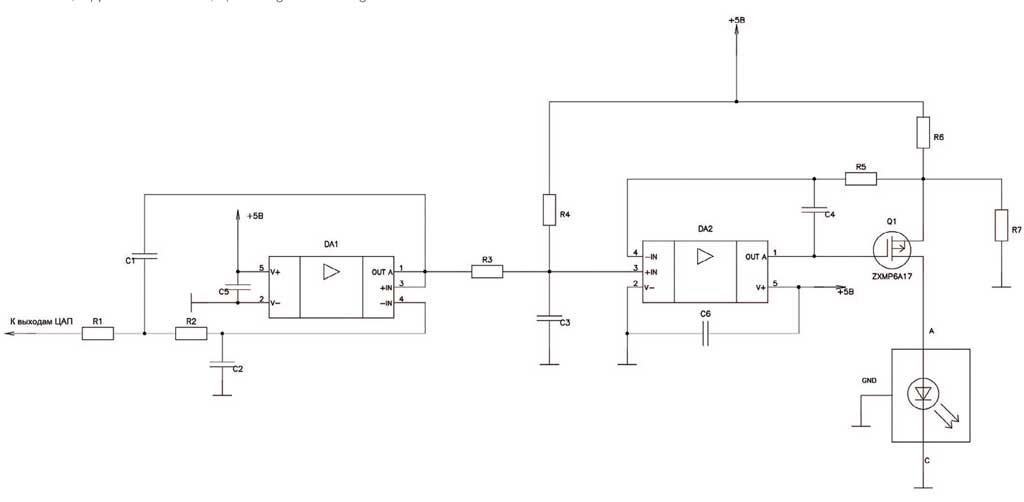
Рис. 3. Канал драйвера питания лазерного диода
Fig. 3. Channel of the laser diode power supply driver
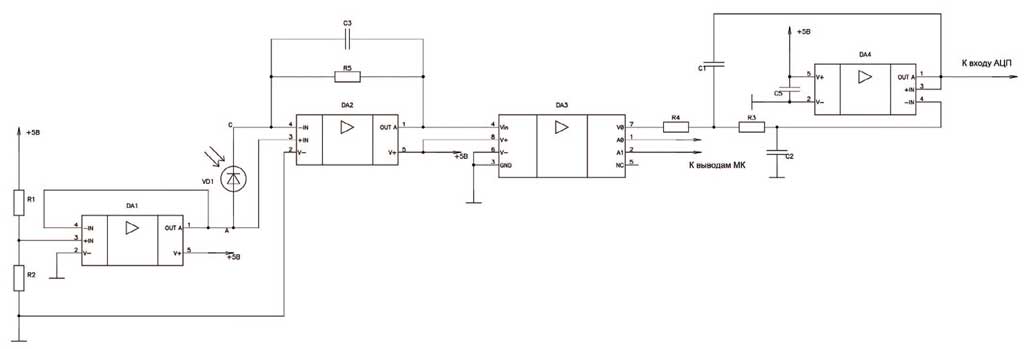
Рис. 4. Схема включения фотодиода
Fig. 4. Photodiode connection diagram
Иммуноферментный анализ
Иммуноферментный анализ (ИФА) — это лабораторный метод, используемый для качественного или количественного определения различных низкомолекулярных соединений, макромолекул, вирусов и других веществ, основанный на специфической реакции между антигеном и антителом [11]. Для выявления образовавшегося комплекса применяется фермент в качестве метки для сигнализации. Теоретические основы ИФА базируются на современных знаниях в области иммунохимии и химической энзимологии, а также на понимании физико-химических закономерностей реакции антиген-антитело и принципов аналитической химии [12, 13].
Технология ИФА [14]
- Получение антител к нужному белку.
- Добавление исследуемого раствора в лунку планшета из полистирола.
- Инкубация в течение 30 минут при температуре +37°C.
- Трехкратная промывка, которая позволяет удалить лишние антитела, не прикрепившиеся к планшету.
- Добавление конъюгата, который занимает свободные места и предотвращает связывание антител. В качестве конъгата обычно используется бычий сывороточный альбумин (БСА) или обезжиренное молоко.
- Инкубация еще 30 минут при +37°C.
- Пятерная промывка для удаления избыточного конъгата.
- В ячейку добавляются вторичные антитела — антитела к исследуемым антителам. Каждое из этих антител связано с ферментом, который катализирует реакцию, приводящую к образованию цветных продуктов. Также добавляется субстрат для фермента, что обеспечивает создание цветного продукта.
- Инкубация в течение 10-20 минут при температуре +18-25°C в темноте.
- Добавление стоп-реагента.
- Использование фотометрического метода для определения разницы в цвете между контрольным и исследуемым образцом. Чем ярче цвет, тем выше концентрация искомого белка.
Интерстиций и интерстициальная жидкость
Интерстицием называют полости в РВСТ (рыхлой волокнистой соединительной ткани), которая имеет следующий клеточный состав: тканеобразующие клетки, клетки крови и их производные, клетки, окружающие сосуды, клетки со специальными функциями.
Клетки находятся в межклеточном веществе, которое состоит из волокон и основного аморфного вещества [15]:
Таблица 1. Cостав межклеточного вещества
Table 1. The composition of the intercellular substance
| Волокна | Kоллагеновые и эластические |
|---|---|
| Основное аморфное вещество |
|
Жидкость попадает в интерстиций путем диффузии из просвета капилляров и делится на 2 типа:
- Тканевой гель: жидкость между молекулами ПГА
- Свободная жидкость: в составе ручейков и везикул, не связана с ПГА
Перспективы работы с интерстициальной жидкостью
- В интерстициальной жидкости могут находиться антигены на антигенпредставляющих клетках (разрушенный и переработанный антиген в комплексе с белками, это нужно для опознания их клетками иммунной системы)
- Малоинвазивный метод исследования
- Быстрота проведения анализа
- Ниже вероятность заражения благодаря большому количеству макрофагов и плазматических клеток
- С социальной точки зрения использование интерстициальной жидкости для проведения анализов представляется благоприятным в психологических аспектах (если пациент отказывается сдавать кровь по религиозным или другим соображениям)
Методы отбора интерстициальной жидкости
Для качественного анализа необходимо подобрать подходящий метод забора ИСЖ. Одним из наиболее атравматичных вариантов может стать применение микроиглы. Такой подход обеспечивает достаточные объемы ИСЖ для последующего анализа на перечень заболеваний с использованием технологии фотометрии. Приоритетами использования данной технологии являются малоинвазивность, высокая специфичность, быстрота изготовления, не требует специального обучения персонала.
Одним из перспективных методов является отбор с помощью микроигольного пластыря [16]
Пластыри MN (microneedle) были вырезаны из листов нержавеющей стали толщиной 100 мкм методом литографическиопределенного химического травления. К ним приклеена полоска фильтровальной бумаги, которая служит резервуаром собираемой жидкости.
Разработана 3D-модель малоинвазивного устройства (рис. 5) и 3D модель умных часов (рис. 6).

Рис. 5. 3D-модель малоинвазивного устройства
Fig. 5. 3D model of a minimally invasive device

Рис. 6. 3D модель «Умных часов»
Fig. 6. 3D model of «Smart Watches»
Был разработан макет приложения (рис. 7), которое будет включать такие функции, как:
вызов врача, поиск ближайших магазинов с доставкой, измерение уровня антител в определенный период времени, информация о коронавирусе, статистика по заболеваемости, мониторинг пульса, учет дней карантина, отслеживание людей с повышенной температурой и измерение температуры. Создан логотип компании (рис. 8).

Рис. 7. Макет приложения
Fig. 7. Application layout

Рис. 8. Логотип компании «SARS-COV-METR»
Fig. 8. The logo of the company «SARS-COV-METR»
В социальных сетях состоялся опрос, чтобы выяснить, насколько интересен стартап молодежи. Результаты показывают, что данный проект имеет хорошие шансы на популярность среди молодежи. Забота о здоровье остается важной для людей, что обеспечит высокий спрос на продукт.
ВЫВОДЫ
В ходе работы получена схема работы ИФА, функциональная схема иммуноферментного фотометра, схема канала драйвера питания, схема включения фотодиода, 3D модели малоинвазивного устройства, смарт-часов и макет приложения.
Проведя анализ литературы и представленного способа диагностики крови и интерстициальной жидкости в организме человека, можно сделать вывод, что с социальной точки зрения система анализа антигенов с помощью метода фотометрии поможет людям следить за крайне важными показателями здоровья, поможет на ранних сроках обнаружить болезнь и проводить исследования по большому количеству антигенов, а не по нескольким. Люди будут уверены в наличии или отсутствии ряда заболеваний, что поможет им улучшить качество жизни.
Данное устройство поможет снизить заболеваемость по всему миру, ведь чем раньше обнаружена болезнь, тем легче ее победить. Помимо этого, предполагают сильное уменьшение риска развития осложнений заболевания и вероятности появления сопутствующих болезней.





































