ВВЕДЕНИЕ
Общемировая заболеваемость мочекаменной болезнью (МКБ) составляет 56,67 случаев на 100 тыс. населения [1]. При этом прогнозируется, что до 15% населения в мире столкнется с данным заболеванием в течение жизни [2, 3]. Следует отметить, что частота заболеваемости МКБ варьируется в различных странах: от 7–13% в Северной Америке, 5–9% в Европе, 1–5% в Азии и до 9% в странах Среднего Востока и неуклонно увеличивается [4, 5]. По данным исследовательского центра по изучению глобального бремени болезней (GBD), включающим 204 страны, за 2019 г. наибольшая распространенность МКБ зафиксирована в странах Восточной Европы и на территории Российской Федерации (рис. 1) [1].
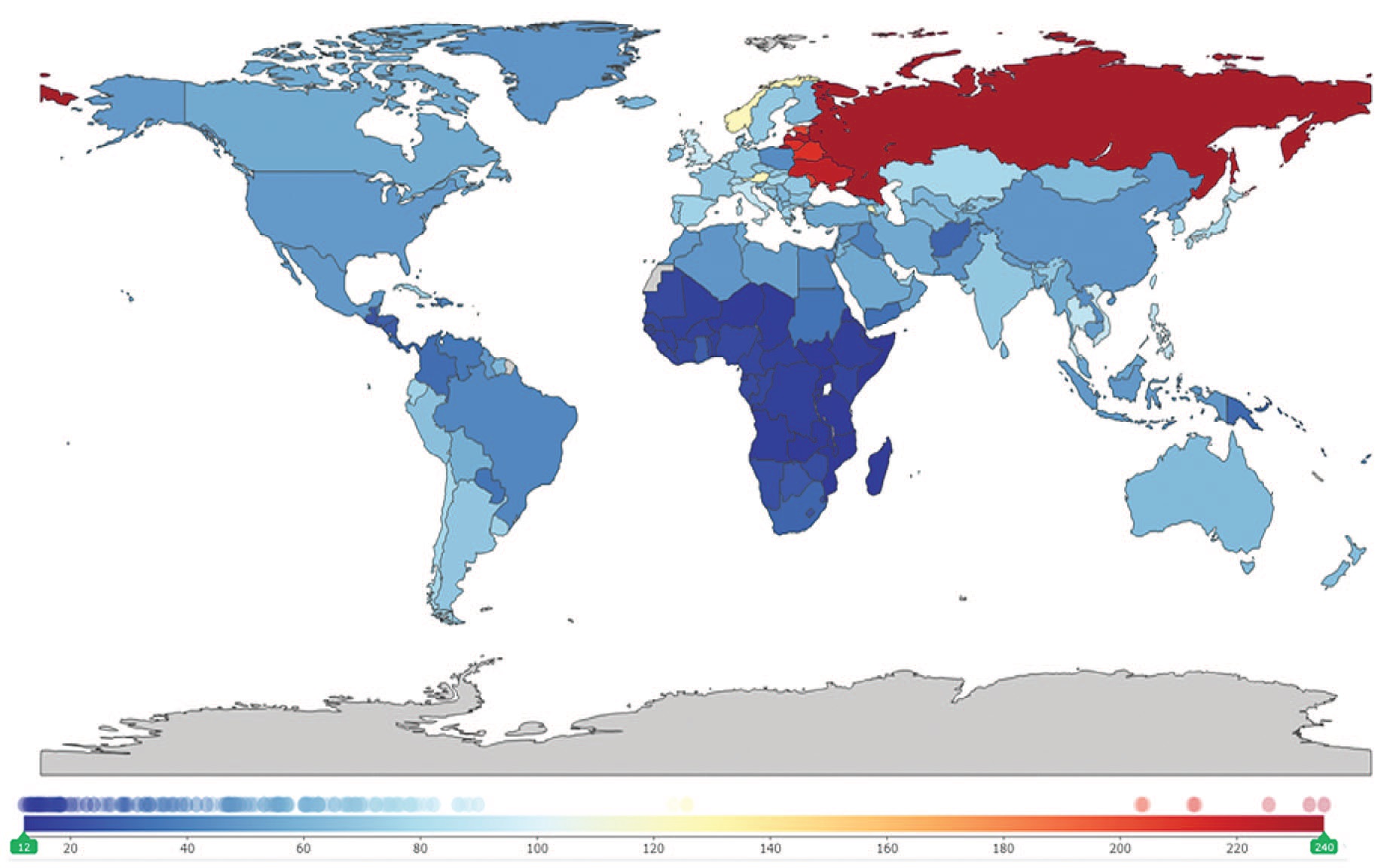
Рис. 1. Распространенность МКБ в мире на 100 000 населения по данным GBD в 2019 г. [1]
Fig. 1. GBD global prevalence of kidney stone disease per 100,000 population in 2019 [1]
GBD объединяет самые полные данные и анализ мировых тенденций в области глобального здравоохранения. Исследования GBD, проводимые при институте показателей и оценки здоровья (IHME), являются на сегодняшний день наиболее полными в мире обсервационными эпидемиологическими исследованиями [1].
Стандартизированный по возрасту коэффициент заболеваемости (ASIR) мочекаменной болезнью на 100 тыс. населения в 2019 г. составил 1394 (95% ДИ [1126,4 – 1688,2]), с самыми высокими показателями в Российской Федерации (4541,9; 95% ДИ [3648,9 – 5522,0]), за которой следуют Украина (4282,6; 95% ДИ [3377,6 – 5271,8]) и Латвия (4156,7; 95% ДИ [3404,7 – 5049,0]), а самые низкие показатели отмечены в Бурунди (525,01; 95% ДИ [408,4 – 646,9]), за которым следует Южный Судан (533,4; 95% ДИ [416,2 – 657,5]). Самый высокий ASIR на 100 000 населения с поправкой на инвалидность (DALY) в 2019 г. был в Армении (33,3; 95% ДИ [21,7 – 61,3]), за ней следует Российская Федерация (24,7; 95% ДИ [19,7 – 30,6]), а самый низкий ASIR DALY оказался в Кабо-Верде (2,3; 95% ДИ [1,5 – 3,2]). Стандартизованный по возрасту коэффициент смертности (ASDR), связанной с мочекаменной болезнью, как правило, составлял менее одного на 100 000 населения планеты, и только показатель Армении превысил это значение, составив 1,8 (95% ДИ [0,9 – 4,0]) [1].
По данным отечественных авторов, пациенты с МКБ составляют около 30–40% больных урологических стационаров, а доля МКБ в структуре урологической патологии достигает 35% [6]. По данным официальной статистики Министерства здравоохранения Российской Федерации, за период с 1990 г. по 2014 г. число пациентов с впервые зарегистрированными заболеваниями мочеполовой системы выросло в 2,5 раза и составило 2897 тыс. (19,6 на 100 тыс.) в 1990 г. и 7164 тыс. (50,2 на 100 тыс.) в 2014 г. При этом количество больных МКБ увеличилось в 3,47 раза и составило 623 тыс. (52,9 на 100 тыс.) и 2165 тыс. (183,7 на 100 тыс.) в 1990 г. и 2014 г. соответственно. Нельзя не упомянуть и о рецидивном характере течения заболевания. Ряд авторов отмечают, что риск рецидива нефролитиаза составляет 50% в течение 5 лет и 80-90% в течение 10 лет [7, 8]. Все эти обстоятельства определяют высокую актуальность проблемы диагностики, лечения и профилактики МКБ.
В настоящее время наблюдается активная интеграция искусственного интеллекта (машинное обучение, глубокое обучение, обработка естественного языка, компьютерное зрение) в автоматизированное решение прикладных задач в медицине за счет высокой точности работы искусственных систем, возможности их тюнинга, способности к обработке больших массивов данных в короткие временные интервалы [9].
В связи с этим актуальным представляется разработка персонифицированного подхода в диагностике, лечении и профилактике с использованием методов машинного обучения и компьютерного зрения, позволяющих помочь выбрать оптимальный алгоритм ведения пациентов с МКБ.
Прогнозирование потенциальных осложнений и управление рисками на предоперационном этапе являются значимыми задачами организации лечебно-диагностического процесса. В настоящее время в реализации прогнозирования используются как методы классического математического анализа (метод квадратов, статистические методики, дискриминантный̆ анализ, корреляционно-регрессионный анализ, математическое моделирование), так и более сложные методы с использованием методов машинного обучения.
Целью обзора является анализ текущего состояния исследований по применению технологий искусственного интеллекта в неинвазивной диагностике, лечении и профилактике МКБ.
МАТЕРИАЛЫ И МЕТОДЫ
Обзор медицинской литературы, опубликованной в период с 2000 г. по 2021 г., был проведен в декабре 2021 г. с использованием данных информационно-аналитических систем MEDLINE, Scopus, Clinicaltrials.gov, Google Scholar и Web of Science. Стратегия поиска проводилась в соответствии с критериями PICO (Пациент–Вмешательство–Сравнение–Исход), согласно которой пациентам с МКБ (P) диагноз валидировался с помощью алгоритмов на основе искусственного интеллекта и/или тактика лечения выбиралась с применением алгоритмов искусственного интеллекта в качестве системы поддержки принятия решения (I) в сравнении с традиционными методами биомедицинской статистики (C) с последующей оценкой достоверности примененных алгоритмов машинного обучения (O) [10]. Для поиска медицинской литературы были использованы следующие ключевые слова: урология, искусственный интеллект, нейронные сети, машинное обучение, мочекаменная болезнь, камни в мочеточнике, камни в почках, хирургическое лечение мочекаменной болезни, эндоурология, «ML», «ANN», «сверточные сети», «CNN», «глубокое обучение», «DL», «обработка естественного языка», «NLP».
Обзор выполнен в соответствии с контрольным перечнем предпочтительных элементов отчетности для систематических обзоров и метаанализов (PRISMA).
В результате поиска отобрано 519 научных публикаций. Критерии включения: оригинальные статьи по МКБ и искусственному интеллекту; полнотекстовые статьи по диагностике, планированию лечения, результатам лечения и/или оценки прогностического потенциала, разработанных алгоритмов и/или моделей на основе машинного обучения. Критерий исключения: наличие одного резюме статьи, обзорные статьи, заметки и комментарии редактора, главы из книг; экспериментальные и лабораторные исследования на животных или кадавер моделях. После скрининга на соответствие критериям включения были исключены 465 научных публикаций, 54 исследования – отобраны для детального анализа. Краткая характеристика ключевых оригинальных исследований представлена в таблице 1.
Таблица 1. Краткая характеристика ключевых исследований по МКБ с использованием методов машинного обучения
Table 1. A descriptive summary of a number of studies on artificial intelligence for kidney stone disease
| №, п/п |
Авторы / Authors |
Цель иссследования / Aim of the study |
Материал исследования / Material |
Тип данных / Type of the data |
Обучающая выборка/ Training set |
Проверочная выборка / Test set |
Алгоритм машинного обучения / Machine learning method |
Чувствительность / Sensitivity |
Специфичность / Specificity |
Точность / Accuracy |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Parakh и соавт. Parakh et al. [21] | оценка точности каскадной сверточной нейронной сети (CNN) в диагностике МКБ по данным КТ / o investigate the diagnostic accuracy of cascading CNN for urinary stone detection on unenhanced CT images | n=535 | КТ изображения / CT scans | 435 | 100 | CNN: GrayNet-SB | 94,0 [87,4;100] | 96,0 [90,6;100] | 95,0 [90,7;99,3] |
| CNN: ImageNet-SB | 90,0 [81,7;98,3] | 92,0 [84,5;99,5] | 91,0 [85,4;96,6] | |||||||
| CNN: Random-SB | 86,0 [76,4;95,6] | 90,0 [81,7;98,3] | 88,0 [81,6;94,4] | |||||||
| 2 | Verma и соавт. Verma et al. [18] | разработка метода предобработки УЗИ изображений для диагностики МКБ / To develop an ultrasound image preprocessing method to predict urinary stones | нет данных/ NA | УЗИ изображения / ultrasound images | нет данных / NA | нет данных / NA | метод k-ближайших соседей / kNN | нет данных / NA | нет данных / NA | 89% |
| метод опорных векторов / SVM | нет данных / NA | нет данных / NA | 84% | |||||||
| 3 | Jendebergи соавт. Jendeberg et al. [17] | дифференциация камней дистального отдела мочеточника от тазовых флеболитов / 1 develop and validate a CNN using local features for differentiating distal ureteral stones from pelvic phleboliths | n=341 | КТ изображения без контраста / non-con-trast-en-hanced CT | 384 | 100 | 2,5D CNN | 94% | 90% | 92% |
| 4 | Nithya и соавт. / Nithya et al. [19] | разработка алгоритма для детекции и сегментации конкрементов / o design and develop an approach for kidney disease detection and segmentation using a combination of clustering and classification approach | 100 изображений для классификации и сегментации / 100 images for detection and segmentation | УЗИ изображения / ultrasound images | 805 изображений из открытых данных / 805 images from open data sets | 20% | ANN | 100 | 90 | 93,45 |
| метод k-ближайших соседей / kNN | 66,66 | 90 | 84,61 | |||||||
| гибридный алгоритм Байесовского классификатора с деревом решений / Naive bias | 63,57 | 89,7 | 83,64 | |||||||
| 5 | Viswanath и соавт. / Viswanath et al. [20] | разработка алгоритма для детекции локализации конкремента / 1 develop an algorithm for predicting the location of urinary stones | 500 изображений / 500 images | УЗИ изображения / ultrasound images | нет данных / A | нет данных / NA | многослойный перцептрон Румельхарта / MLP | нет данных / NA | нет данных / NA | 98,8% |
| 6 | Hokamp и соавт. / okamp et al. [22] | определение химического состава конкрементов/ o predict the chemical composition of urinary stones | 200 КТ изображений сегментированы на 75 735 вок-селей / 200 CT scans segmented in 75,735 voxels | КТ изображения / CT scans | n=53.015 (вокселей / voxels) | n=11.360 (вокселей / voxels) | SNN | 100% | нет данных / NA | 87,1% до 91,1% |
| 7 | Krishna и соавт. [41] | диагностика МКБ по данным УЗИ / To predict urinary stones using ultrasound images | 250 изображений (138 c МКБ и 120 с кистой почки) / 0 images (138 with urinary stones and 120 with cysts) | УЗИ изображения / ultrasound images | 150 изображений (75 с МКБ и 75 с кистой почки)/ 50 images (75 with urinary stones and 75 with cysts) | 108 изображений (63 с МКБ и 45 с кистой почки) / 108 images (63 with urinary stones and 45 with cysts) | метод опорных векторов + многослойный перцептрон Румельхарта/ SVM | 100% | 96,82% | 98,14% |
| 8 | Kreigshauser и соавт. [25] | 400определение химического состава конкрементов / To predict the chemical composition of urinary stones | 32 эксплан-тированных конкремента / 32 explanted stones | КТ изображения / CT scans | нет данных / NA | нет данных / NA | ANN | нет данных / NA | нет данных / NA | 97% при определении конкрементов из мочевой кислоты |
| дерево решений / Decision Tree | нет данных / NA | нет данных / NA | 91% при определении конкрементов из мочевой кислоты | |||||||
| случайный лес / Random Forest | нет данных / NA | нет данных / NA | 94% при определении конкрементов из мочевой кислоты | |||||||
| метод опорных векторов / SVM | нет данных / NA | нет данных / NA | 97% при определении конкрементов из мочевой кислоты | |||||||
| гибридный алгоритм Байесовского классификатора с деревом решений / aive bias | нет данных / NA | нет данных / NA | 97% при определении конкрементов из мочевой кислоты | |||||||
| 9 | Black и соав. [16] | определение химического состава конкрементов / To predict the chemical composition of urinary stones | 127 цифровых изображений / 127 digital images | Цифровые изображения эксплантирован-ных конкрементов / Digital images of the explanted stones | нет данных / NA | нет данных / NA | CNN ResNet-101 | 71,43-95 | 96,47-98,31 | 75-94% |
| 10 | Cummings и соавт. [30] | прогнозирование спонтанного отхождения камней / predict spontaneous urinary stone passage | 181 пациентов/ 181 patients | Клинико-анамнестические данные Clinical and demographic variables | 125 пациентов / 125 patients | 56 пациентов / 56 patients | многослойная нейронная сеть / multilayer neural network | 76% | нет данных/ NA | 100% |
| 11 | Aminsharifi и соавт. [31] | прогнозирование исходов после ПНЛ / о predict outcomes following PCNL | 146 пациентов / 146 patients | Клиникоанамнестические данные, периоперационные данные, КТ изображения / Clinical and demographic variables, perioperative variables, CT scans | нет данных / NA | нет данных / NA | ANN + метод опорных векторов / ANN + SVM | нет данных / NA | нет данных/ NA | 80-95% |
| 12 | Chiang и соавт. [27] | прогнозирование риска развития МКБ на основе данных генетики и образа жизни / predict the incidence of stone disease using genetic polymorphisms and from patients drinking and exercise habits | 151 пациент 151 patients | Клинико-анамнестиче-скиеданные+данные генетического исследования / linical and demographic variables + genetic variables | нет данных / NA | нет данных / NA | ANN + многослойный перцептрон Румельхарта / ANN+MLP | нет данных / NA | нет данных/ NA | 89% |
| 13 | Shabaniyan и соавт. [32] | прогнозирование клинических исходов после ПНЛ / To predict outcomes following PCNL | 254 пациента / 254 patients | Клинико-анамнестические данные, инструментальные данные, клиниколабораторные данные / Clinical and demographic variables, instrumental variables, laboratory variables | нет данных / NA | нет данных / NA | квадратичный дискриминантный анализ +SFS / QDA+SFS | 71,1% | 69,5% | 70,3% |
| квадратичный дискриминантный анализ +SFS+FDA / QDA+SFS+FDA | 72,3% | 84,7% | 78% | |||||||
| метод k-ближайших соседей +SFS / kNN+SFS | 80,7% | 65,3% | 73,5% | |||||||
| метод k-ближайших соседей +SFS+FDA / kNN+SFS+FDA | 85,6% | 72,3% | 79,4% | |||||||
| многослойный перцептрон Румельхарта +SFS / MLP + SFS | 71,1% | 55,6% | 63,9% | |||||||
| многослойный перцептрон Румельхарта +SFS+FDA / MLP + SFS +FDA | 81,9% | 68,1% | 75,5% | |||||||
| метод опорных векторов +SFS / VM + SFS | 92,7% | 91,6% | 92,3% | |||||||
| метод опорных векторов +SFS+FDA / SVM + SFS + FDA | 100,0% | 88,9% | 94,8% | |||||||
| 14 | Seckiner и соавт. [36] | разработка прототипа нейронной сети для прогнозирования исходов лечения после УВЛ / To develop a neural network prototype to predict outcomes after SWL | 203 пациента / 203 patients | Клинико-анамнестические данные, периоперационные данные / Clinical and demographic variables, perioperative variables | 139 пациентов / 139 patients | 32 пациента / 32 patients | ANN | нет данных / NA | нет данных / NA | 99,25% в обучающей выборке, 85,48% в проверочной выборке и 88,70% в тестовой выборке / 99.25 in the training set, 85.48% in the validation set, and 88.70% in the test set |
| 15 | Langkvist и соавт. [39] | разработка алгоритма для диагностики МКБ / To develop an AI-based algorithm to predict kidney stone disease | 437 изображений / 437 images | КТ изображения/ CT scans | 348 | 88 | CNN | 100% | нет данных / NA | нет данных / NA |
| 16 | Ishioka и соавт. [40] | разработка алгоритма для диагностики МКБ / To develop an AI-based algorithm to predict kidney stone disease | 1017 изображений / 1017 images | Рентгенограммы / X-ray images | 827 | 190 | CNN ResNet | 0,72 | нет данных / NA | нет данных / NA |
ДИДЖИТАЛИЗАЦИЯ В ЛЕЧЕБНО-ДИАГНОСТИЧЕСКОМ ПРОЦЕССЕ
Ключевым этапом определения тактики лечения является не только постановка самого диагноза МКБ, но и определение состава конкрементов.
Состав и локализация конкремента являются ключевыми факторами для своевременного и качественного лечения больных МКБ. Сейчас недостаточно удалить камень тем или иным оперативным методом, так как минералогический состав камня служит основой̆ для диагностики и определения тактики лечения [11]. Степень риска рецидива камнеобразования определяется химическим составом конкремента и тяжестью заболевания [12]. Для выполнения инфракрасной спектрометрии с целью определения состава камня необходимо выполнить операцию и предоставить камень на анализ. В свою очередь применение текстурного анализа и глубокого машинного обучения с использованием данных КТ дает уникальную возможность определения химического состава камня неинвазивным методом.
Ряд исследователей сообщает об определении состава камней непосредственно по данным КТ исследований в ручном режиме [13, 14]. Однако, по мнению Fitri и соавт., подобная интерпретация является трудоемкой, она ассоциирована с наличием потенциальных погрешностей и всецело зависит от опыта и компетенций специалиста, что обуславливает актуальность разработки автоматизированных алгоритмов детекции, сегментации и определении химического состава камней [15].
Одним из перспективных направлений применения машинного обучения в диагностике МКБ является обработка медицинских изображений и постановка диагноза на этой основе. Золотым стандартом диагностики МКБ является проведение КТ с получением данных в отраслевом стандарте DICOM (Digital Imaging and Communications in Medicine) с теговой организацией: пациент – исследование – серия – изображение (кадр или серия изображений). КТ-изображение является результатом вычислений, а не проекционным теневым изображением. Учитывая сложность интерпретации полученных изображений с учетом несколько тысяч оттенков серого, перспективным представляется использование технологии компьютерного зрения и машинного обучения для решения вышеобозначенных задач. Классификация изображений искусственным интеллектом с использованием методов глубокого обучения для поиска и установления определенных зависимостей и построение прогноза на основе данных зависимостей позволит провести персонифицированный учет потенциальных рисков и подобрать тактику лечения индивидуально для каждого пациента еще на предоперационном этапе [16].
ОПРЕДЕЛЕНИЕ ЛОКАЛИЗАЦИИ КОНКРЕМЕНТА ПО ДАННЫМ УЗИ И КТ
Jendeberg и соавт. провели разработку и валидацию «2,5D» сверточной нейронной сети («2,5D CNN») для дифференциации камней дистального отдела мочеточника от тазовых флеболитов на основе данных КТ исследований без контрастного усиления [17]. Авторы разработали классификатор на основе ансамбля трех 2D CNN, анализирующих изображения в перпендикулярных плоскостях, при этом воксель с конкрементом был точкой пересечения (рис. 2) [17].
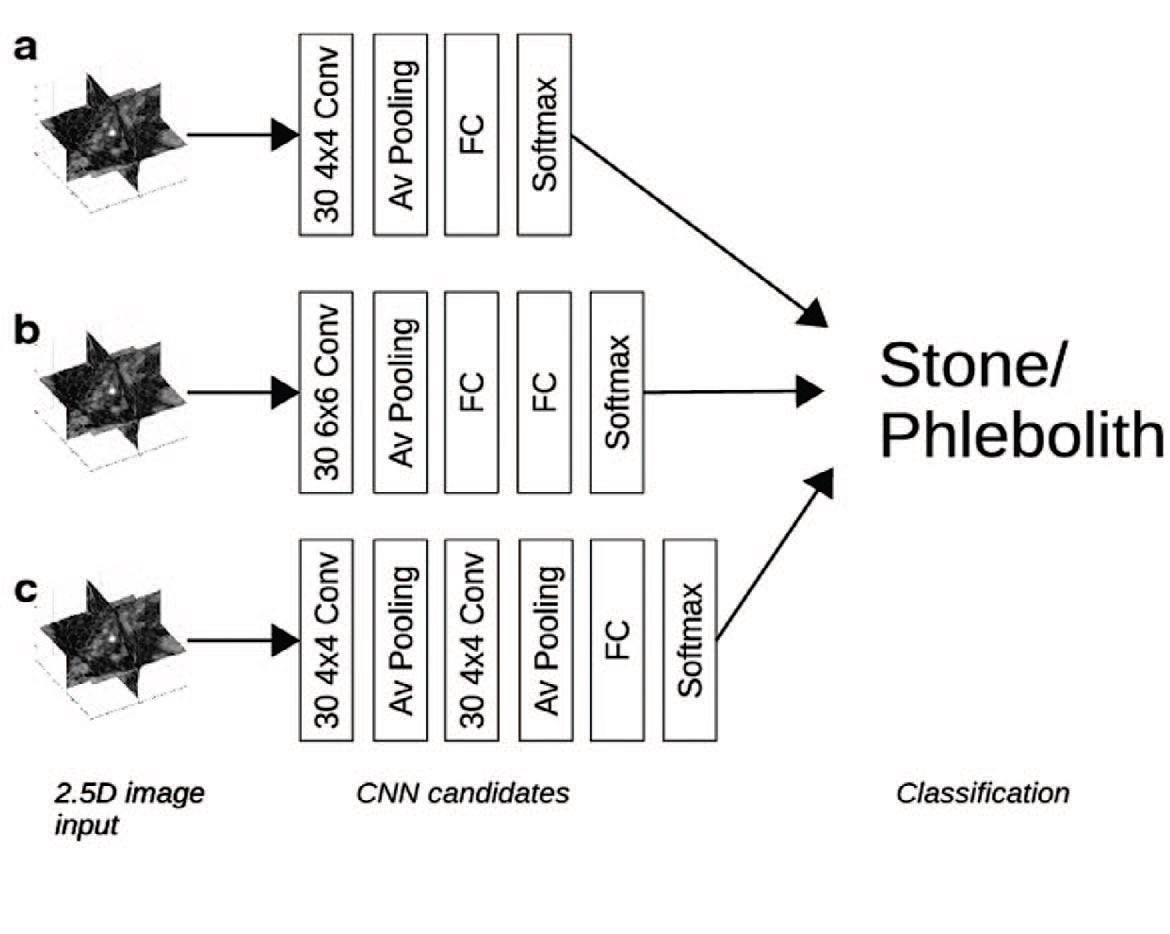
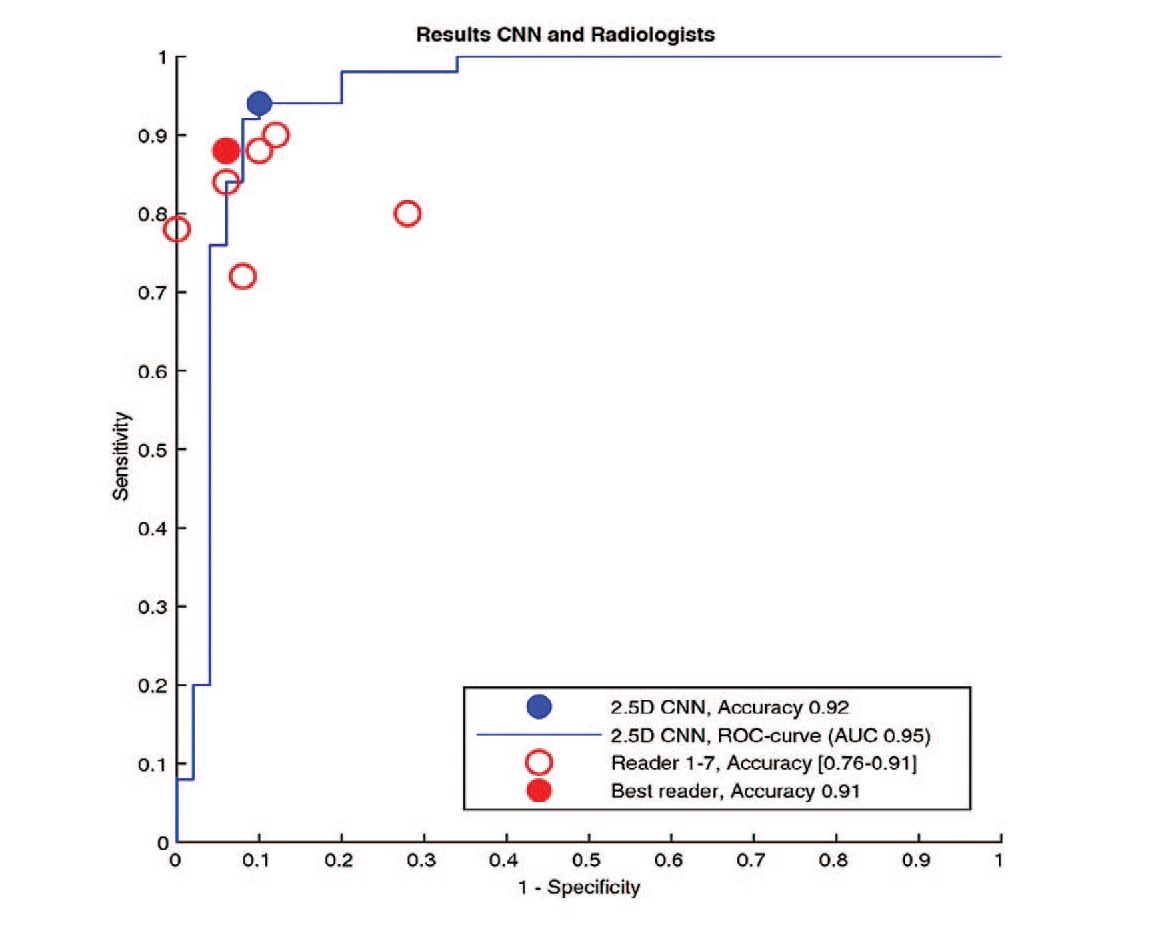
Рис. 2. Архитектура нейросети 2,5D CNN и ROC-кривая для алгоритма на основе машинного обучения по сравнению с точностью оценок семи рентгенологов-экспертов [19]
Fig. 2. Schematic architecture of the three 2.5D convolutional network (2.5D-CNN) candidates validated on the test dataset and ROC curve for a convolutional neural network candidate compared to the accuracy of the assessments by seven radiologists [19]
Сравнение эффективности 2,5D CNN проводилось путем сопоставления полученных данных, методом полуколичественной оценки, а также результатов экспертного мнения (оценка рентгенологами при КТ без контрастного усиления). Ретроспективно в исследование был включен 341 пациент с острой почечной коликой, обусловленной камнем в дистальном отделе мочеточника на КТ, либо флеболитом в глубоких венах таза, либо тем и другим. Алгоритм был обучен по изображениям 384 камней и 50 флеболитов и дифференцировал камни и флеболиты с чувствительностью, специфичностью и точностью 94%, 90% и 92%. Это было значительно выше (p=0,03), чем средняя точность диагностики рентгенологом, которая равна 86%. Точность полуколичественного метода составила 49% [17]. Следует отметить, что полученная точность предсказания 92% и AUC 0,95 свидетельствуют о высоком потенциале 2,5D CNN, но для внедрения данной нейросети в клинико-диагностический процесс необходимо улучшение ее производительности. Крайне важно минимизировать количество ложноположительных результатов при классификации камней и других структур. Несмотря на то, что исследовательская группа проводила обучение на большом массиве данных, точность разработанного алгоритма может быть оптимизирована за счет добавления в обучающую выборку изображений, полученных на различных аппаратах с использованием различных протоколов проведения диагностики.
В исследовании Verma и соавт. классификация и сегментация камней проводилась с использованием метода k-ближайших соседей и метода опорных векторов [18]. УЗИ изображения отличает большая однородность с минимальным количеством явных признаков для человеческого глаза. В связи с этим их трудно распознать и разделить. Поэтому для классификации и сегментации УЗИ изображения был проведен его апгрейд с использованием медианного фильтра, фильтра Гаусса и нерезкой фильтрации c последующим методом сегментации энтропии изображения.
Однако несмотря на предварительную обработку и подготовку изображений, финальная точность распознавания осталась неудовлетворительной как для применения метода k-ближайших соседей (89%), так и для метода опорных векторов (84%). Однако исследовательская группа Nithya и соавт. смогла добиться более перспективных результатов при классификации и сегментации УЗИ изображений с использованием метода k-средних [19]. Ключевой сложностью с работой УЗИ изображений является наличие помех в виде спеклов, которые нивелировались с помощью медианного фильтра. Для повышения точности предсказания выделение признаков проводилось с использованием алгоритма crow search optimization (рис. 3) [19].
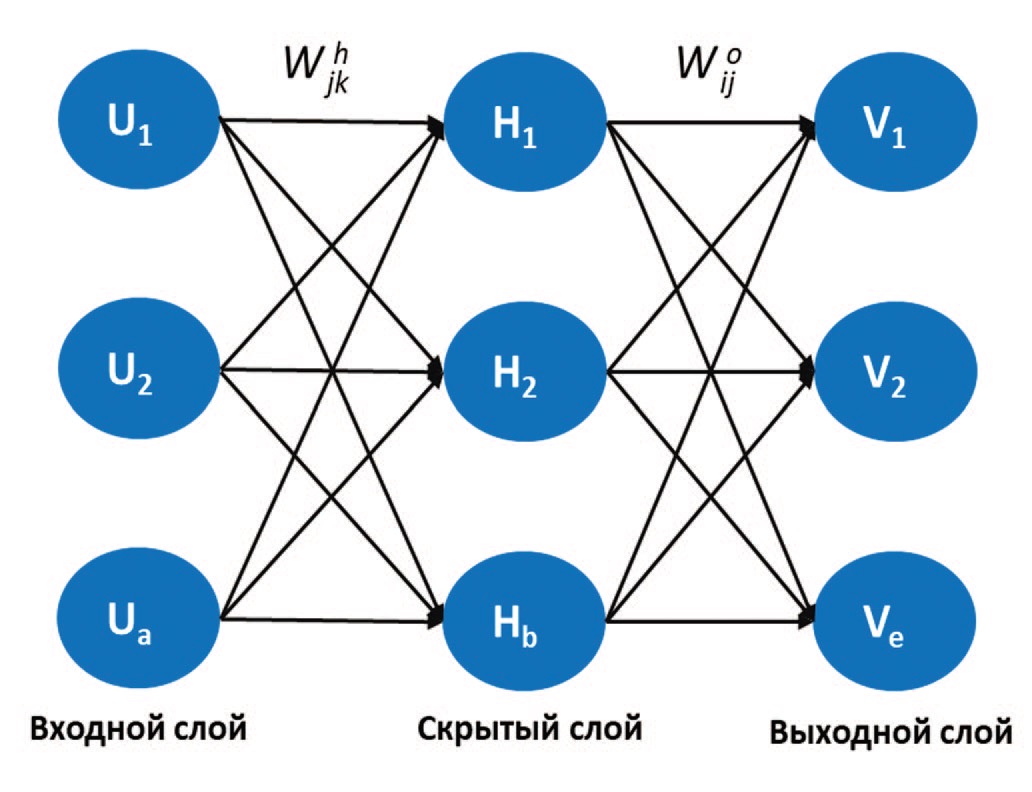
Рис. 3. Архитектура использованной нейросети [20]
Fig. 3. The architecture of the neural network [20]
Алгоритм в основном классифицировал изображение с камнями и без с помощью классификатора, а затем изображения с камнями подвергались дополнительному сегментированию для определения локализации камней. Исследование показало, что кластеризация «multi kernel» k-средних (гибридная линейная и квадратичная модель) достигла точности 99,6% [19].
Для детекции камней Viswanath и соавт. использовали ансамбль архитектур – многослойный перцептрон Румельхарта [20]. Обучение нейросети проводилось на ретроспективной базе данных 500 пациентов с предварительной подготовкой УЗИ изображений с использованием набора фильтров. Авторами была достигнута 98,8% точность распознавания камней. Более того, минимальная скорость автоматизированного алгоритма делает возможным его применение для детекции камней в режиме реального времени.
Следует отметить, что в вышеперечисленных исследованиях методы машинного обучения использовались для решения первичной задачи – классификации изображений с конкрементами и без них. Однако в клинико-диагностическом процессе требуется решение ряда дополнительных задач: определение точной локализации, размера и химического состава.
В исследовании Parakh и соавт. проводилась не только классификация изображений с конкрементами и без, но и с дальнейшей классификаций по группам в зависимости от размера камня (рис. 4) [21]. Была использована нейросеть глубокого обучения с каскадным классификатором. Для обучения нейросети были использованы 435 изображений КТ (n=206 без камней и n=229 с камнями). Значение AUC для автоматической детекции конкрементов варьировалось от 0,92 до 0,95 в зависимости от модели. Точность GrayNet-SB (95%) была выше, чем у ImageNet-SB (91%) и Random-SB (88%). Для камней размером более 4 мм все модели показали одинаковые результаты (ложноотрицательные результаты: 2 из 34). Для камней размером менее 4 мм количество ложноотрицательных результатов для GrayNetSB, ImageNet-SB и Random-SB составило 1 из 16, 3 из 16 и 5 из 16 соответственно. GrayNet-SB распознал камни во всех 22 случаях обструктивной уропатии.
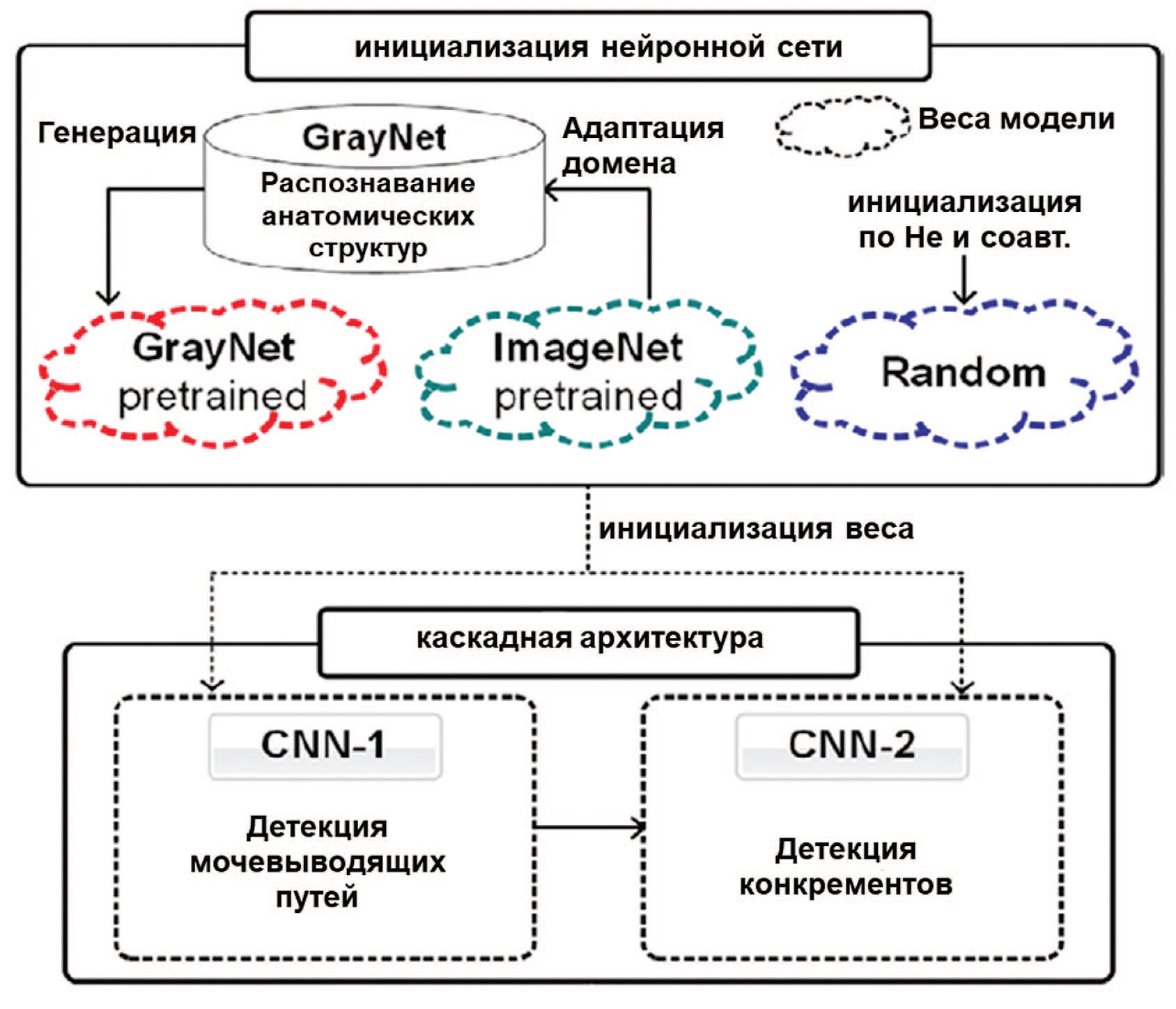
Рис. 4. Нейросеть глубокого обучения с каскадным классификатором [17]
Fig. 4. A Deep Cascade of Convolutional Neural Networks [17]
Hokamp и соавт. оценили потенциал алгоритмов машинного обучения для анализа изображений КТ больных МКБ. Для этого была использована неглубокая нейросеть (shallow neural network), состоящая из одного скрытого и одного выходного слоя, использующего сигмоид как функцию активации (рис. 5) [22].
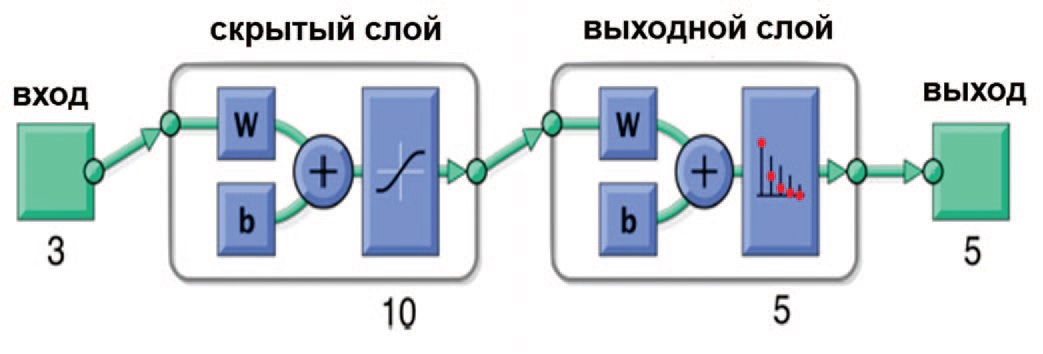
Рис. 5. Архитектура нейросети [22]
Fig. 5. The architecture of the neural network [22]
Всего было включено 200 КТ изображений (n=75,735 вокселей), из них 70% (n=53,015 вокселей) были использованы для обучения нейросети и по 15% (n=11,360 вокселей) для ее настройки и тестирования работоспособности. В результате точность распознавания состава конкрементов варьировалась от 87,1% до 91,1%. Наибольшее количество ошибок при распознавании отмечено в группе конкрементов, состоящих из струвита (51,8%), мочевой кислоты и цистина (23,7% и 23,4% соответственно). Данное исследование подтвердило возможность разработки автоматизированного алгоритма детекции локализации камней на основе анализа вокселей в матрице изображения. Следует отметить, что данное исследование является первым, в котором проводилась бинаризация изображения с последующим поиском компоненты связности графа. При этом при изолированном распознавании конкрементов чувствительность нейросети достигла 100% при 3,69 ложноположительных результатах на пациента при тестировании 88 сканов.
ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО СОСТАВА КОНКРЕМЕНТОВ
Золотым стандартом анализа химического состава конкрементов являются инфракрасная спектроскопия с преобразованием Фурье (ИКФС) и рентгеновская дифракция [23]. Несмотря на то, что оба этих метода широко используются и признаны надежными мировым медицинским сообществом, существует ряд ограничений – присутствие квалифицированного персонала и специализированного оборудования, которые, как правило, есть в производственных и научных лабораториях, а не в медицинских организациях. В связи с этим большое количество медицинских организаций вынуждены отправлять конкременты в специализированные лаборатории, что сопряжено со значительными финансовыми и временными затратами. В связи с этим перспективным представляется автоматизация настоящей задачи и решение ее за счет возможностей машинного обучения.
Kreigshauser и соавт. провели сопоставительную оценку эффективности применения различных алгоритмов машинного обучения – нейросети, дерева решений (Decision Tree), случайного леса (Random Forest), метода опорных векторов (support vector machine) и гибридный алгоритм Байесовского классификатора с деревом решений (Naïve Bayes Tree) – для определения состава камня по КТ изображениям [24]. Наилучшей точностью предсказания, равной 97%, обладали нейросеть, метод опорных векторов и алгоритм Naïve Bayes Tree. При этом точность предсказания достигала 100% при классификации конкрементов по двум простым группам: конкременты, содержащие и не содержащие мочевую кислоту. Наибольшее число ошибок было выявлено в работе алгоритмов дерева принятия решений и Random Forest. Однако при оценке эффективности дальнейшей классификации конкрементов, не содержащих мочевую кислоту, точность предсказания снижалась до 75%, что явно не достаточно для обеспечения качественной диагностики и планирования тактики лечения в предоперационный период.
В исследовании Black и соавт. для определения химического состава конкрементов использовались алгоритмы глубокого обучения [16]. В общей сложности в исследование были включены цифровые фотографии 63 экспланированных конкрементов различного химического состава, включая моногидрат оксалата кальция, мочевую кислоту, гексагидрат фосфата магния-аммония, дигидрат гидрофосфата кальция и цистиновые камни. Для реализации задач многоклассовой классификации химического состава конкрементов по изображению была использована сверточная нейронная сеть ResNet-101 (ResNet, Microsoft), в которой полносвязные слои были заменены на сверточный слой со 128 каналами, оптимизированный с помощью слоя Batch Normalization (пакетная нормализация) и функцией активации ReLU, за которым следовал еще один 128-канальный слой, в обоих слоях случайным образом инициализировались весовые коэффициенты. Softmax использовалась для последнего слоя для задач классификации. Процесс прогнозирования химического состава конкрементов схематично представлен на рисунке 6 [16]. В результате использования вышеприведенной архитектуры, точность распознавания химического состава камней варьировалась от 94% для конкрементов, в составе которых была мочевая кислота, до 71% для конкрементов, в составе которых был брушит. Таким образом, точность (прогнозирования составила 85%, что в целом свидетельствует о наличии позитивного потенциала применения нейросетей для автоматизированного неинвазивного определения химического состава конкрементов [16]. Следует отметить, что в исследовании не использовались конкременты смешанного химического состава и нейросеть не использовалась для определения размера конкремента. Эти результаты заложили основу для будущих исследований по определению состава камня непосредственно по эндоскопическим изображениям.
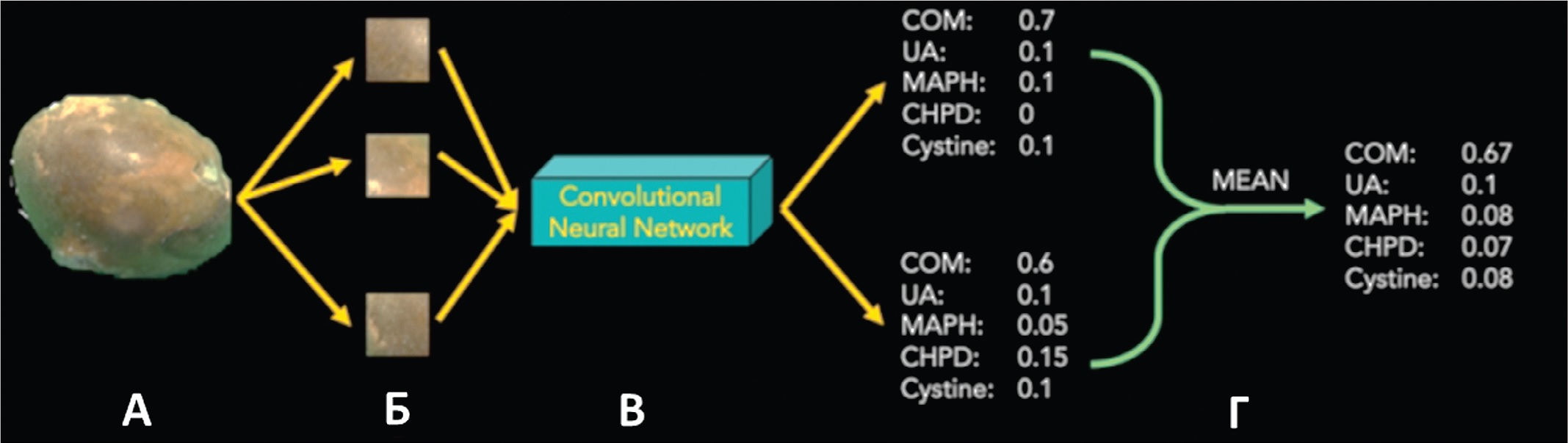
Рис. 6. Образец конкремента и предпоготовка изображения (A и Б) в качестве входных данных; классификация изображения с использованием алгоритма ResNet и оценка точности с использованием метода перекрестной проверки (В); усреднение оценки классификации (Г) [16]
Fig. 6. Samples of the stones cropped using photo editing software (A and B); A deep CNN [ResNet] classifies each image crop and accuracy is assessed using leave-one-out cross validation method (C); Classification scores are averaged to get final prediction (D) [16]
Интересным также представляется исследование Onal и соавт., которые не только разработали алгоритм, позволяющий определить химический состав конкрементов, но и интегрировали его в работу смартфона [25]. В исследование было включено 37 удаленных хирургическим путем камней, состоящих из оксалата кальция, цистина, мочевой кислоты и струвита. Во время выполнения хирургического вмешательства проводилась фрагментация конкрементов. Химический состав камней анализировался с использованием ИКФС. Выходные данные каждого этапа в предложенном подходе выступали в качестве входных данных для следующего этапа (рис. 7) [25].
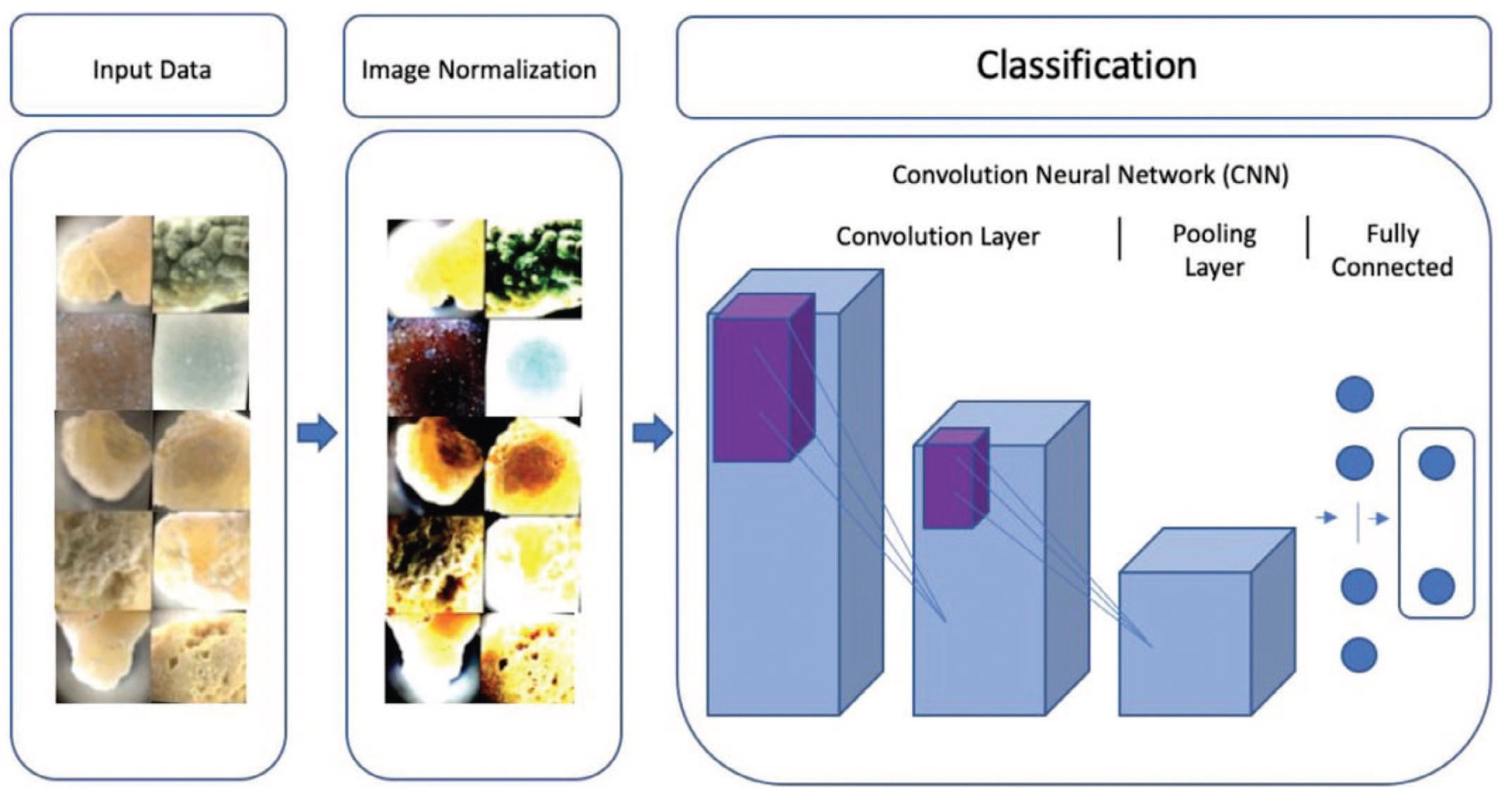
Рис. 7. Пайплайн: последовательные стадии преобразования данных, предшествующие классификации [33]
Fig. 7. Machine learning pipeline for kidney stone classification [33]
Учитывая скорость распознавания изображения с использованием уже имеющихся архитектур (ResNet50, GoogleNet и т.д.), авторами предложена собственная архитектура, представленная четырьмя сверточными слоями, двумя слоями пула и двумя полносвязными слоями (рис. 8).
В результате авторам удалось достичь общей и взвешенной точности 88% и 87% соответственно, со средней метрикой F1-score – 0,84.
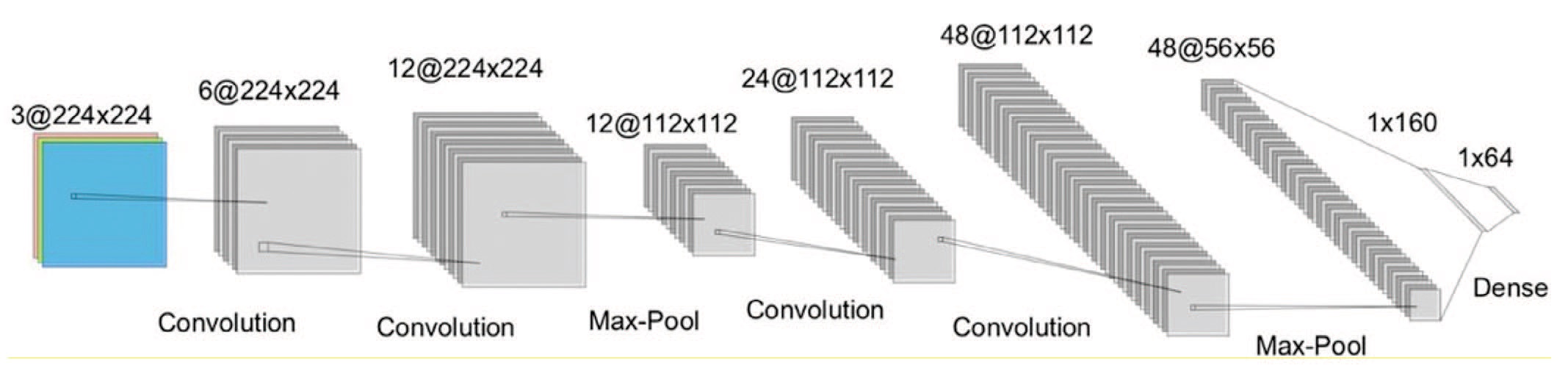
Рис. 8. Архитектура алгоритма: 4 сверточных слоя, 2 слоя пула и 2 полносвязных слоя [33]
Fig. 8. The architecture has four convolutional layers, two pooling layers and two fully connected layers [33]
ПРОГНОЗИРОВАНИЕ ВОЗНИКНОВЕНИЯ И РЕЦИДИВА МКБ
Интересным направлением применения методов искусственного интеллекта является прогнозирование развития МКБ.
В исследовании Chiang и соавт. продемонстрирован высокий потенциал применения нейросетей для обработки большого массива данных в прогнозировании развития МКБ в сравнении с традиционным дискриминантным анализом [26]. Данные 151 пациента с минимум двумя эпизодами образования кальциево-оксалатных камней, подтвержденными ИКФС, сравнивались со 105 условно здоровыми лицами в контрольной группе по четырем генетическим однонуклеотидным полиморфизмам, которые считаются важными при МКБ: цитохром p450c17, E-кадгерин, урокиназа и фактор роста эндотелия сосудов (VEGF). Дополнительно в анализ включались данные об объеме потребляемой жидкости, занятиях спортом на свежем воздухе, а также особенности генетического профиля пациентов – наличие генетических полиморфизмов. Для решения поставленной задачи использовали два метода – трехслойная нейросеть и многослойный перцептрон Румельхарта (рис. 9) [26].
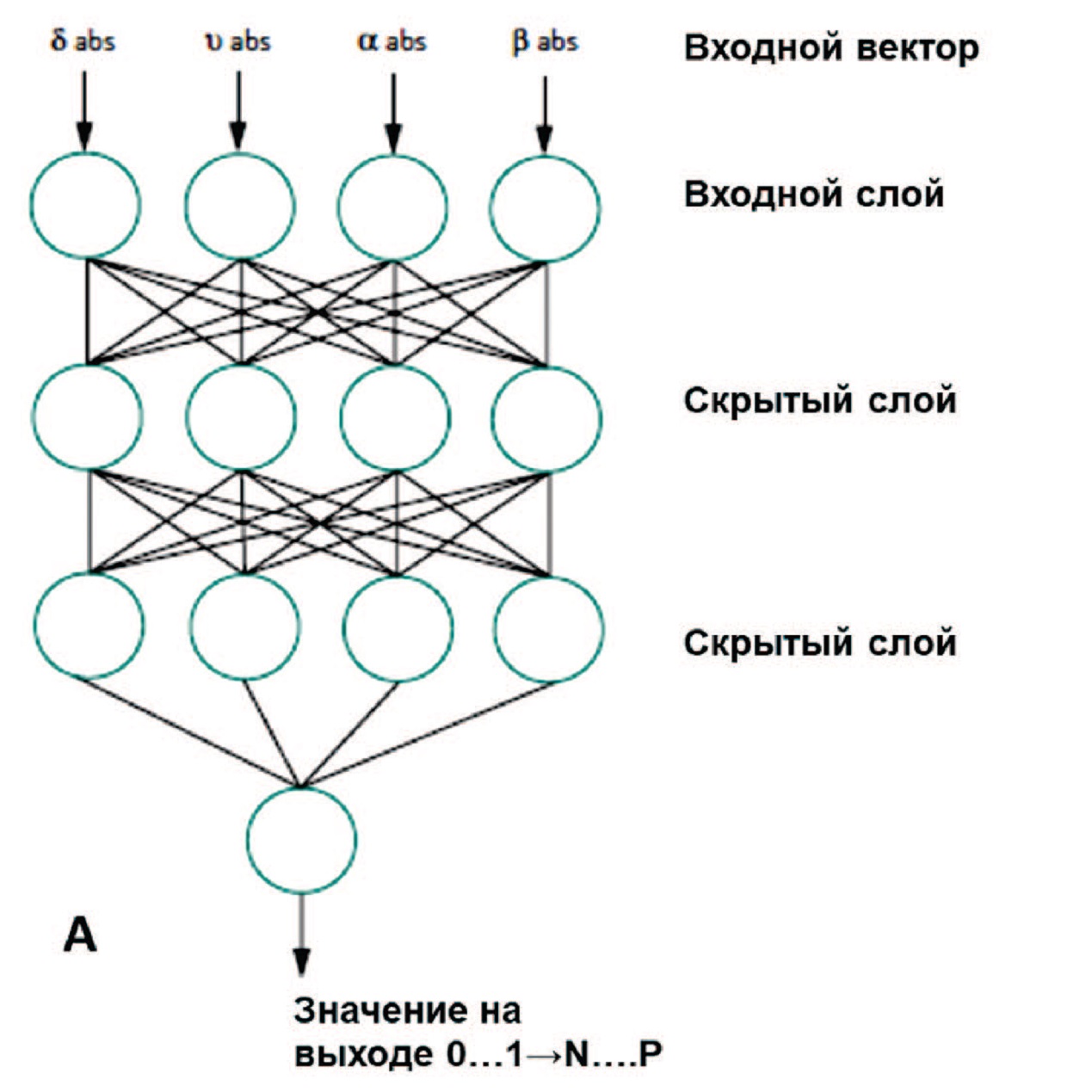
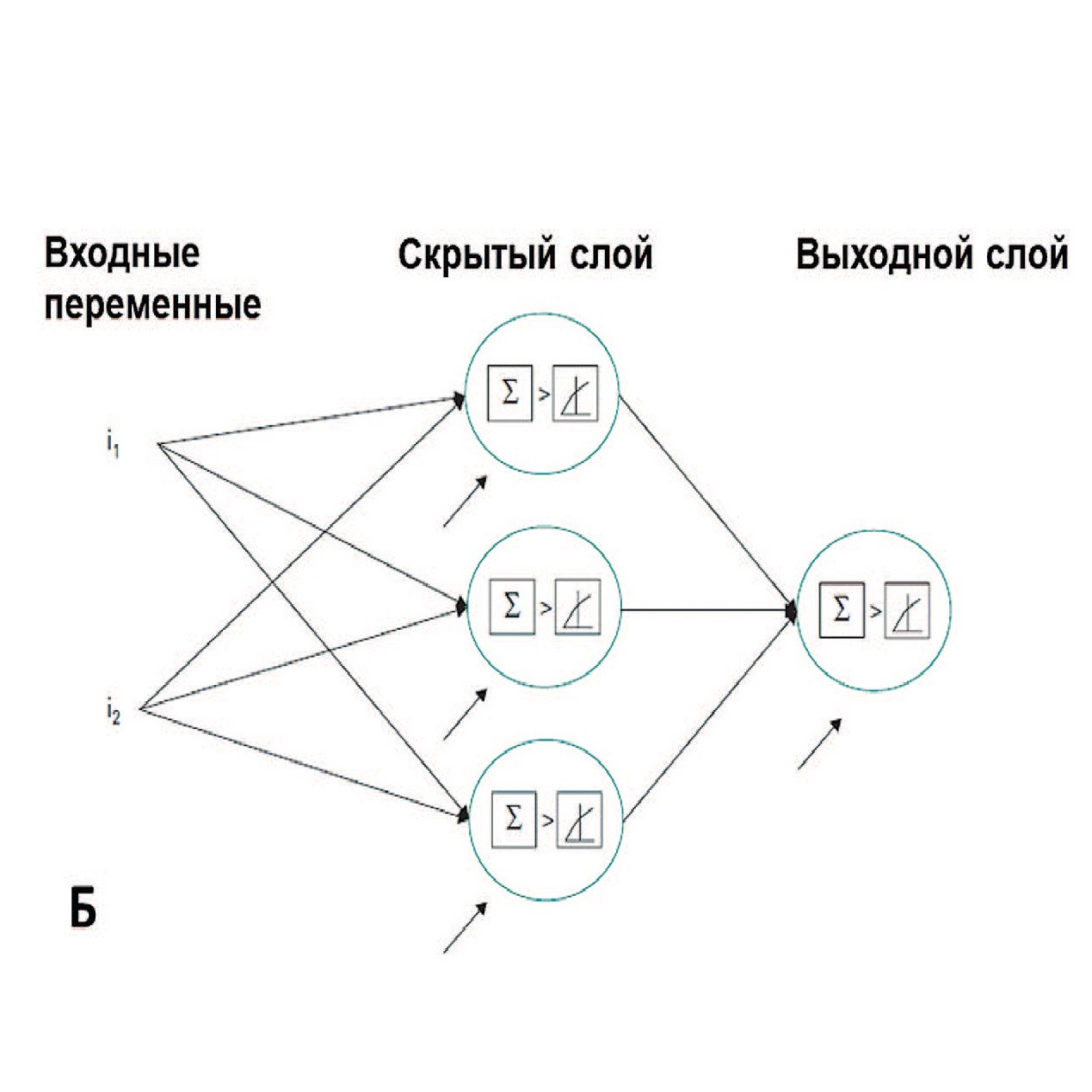
Рис. 9. Архитектура нейронной сети, использованная для классификации МКБ (А); архитектура многослойного перцептрона Румельхарта (Б) [27]
Fig. 9. The architecture of the neural network predicting kidney stone disease (A); multilayer perceptron architecture (B) [27]
Учитывая только данные генетического исследования, прогностическая точность двух методов была сопоставима (64% дискриминантный анализ и 65% нейросеть). Однако при дополнительном включении клинико-демографических характеристик прогностическая точность нейросети увеличивалось до 89% против 75% у дискриминантного анализа. Прогностически значимыми переменными явились наличие гена VEGF, потребление молока и воды.
Tanthanuch М. и соавт. использовали трехслойную нейросеть у пациентов с рецидивирующими почечными или мочеточниковыми камнями для прогнозирования их появления после полной элиминации [27]. Обучение нейросети проводилось на наборе данных 100 пациентов с последующей валидацией на выборке, представленной 68 пациентами. Ключевым критерием включения в исследование был диагноз МКБ с рентгенологическим подтверждением и спектроскопическим анализом. Для обучения нейросети использовались демографические данные пациента, рентгенологический тип камня и его состав. Достоверность работы полученного алгоритма составила 80%. Наиболее значимыми переменными, значительно влияющими на работу алгоритма, были МКБ в анамнезе, нефрокальциноз, состав камней, суточный анализ мочи на цитрат и посев мочи.
В исследовании Batinic и соавт. особое внимание было уделено теории дисбаланса факторов, способствующих увеличению суточного количества мочи, и факторов, уменьшающих этот показатель [28]. Следует отметить, что данное исследование проводилось на педиатрических пациентах. Были сформированы три группы пациентов: группа 1 (n=30) – пациенты с МКБ, группа 2 (n=36) – пациенты с изолированной гематурией и группа 3 (n=15) – условно здоровые лица, которые составили группу контроля. Алгоритм, разработанный на основе искусственного интеллекта, обладал 97,78% точностью, 100% чувствительностью и 93,33% специфичностью в прогнозировании МКБ. При этом прогностически значимыми переменными были пороговые значения соотношения оксалат/цитрат и гликозаминогликаны.
ПРОГНОЗИРОВАНИЕ СПОНТАННОГО ОТХОЖДЕНИЯ КАМНЕЙ И ОПРЕДЕЛЕНИЕ ТАКТИКИ ЛЕЧЕНИЯ
Cummings и соавт. оценили эффективность применения многослойнной нейронной сети, в прогнозировании спонтанного отхождения небольших камней из дистального отдела мочеточника [29]. Данные 181 случая почечной колики, включая случаи, требующие вмешательства, были разделены на обучающую выборку (n=125) и тестовую выборку (n=56). Чувствительность разработанного алгоритма составила 76% при 100% точности в прогнозировании отхождения камней. Однако при прогнозировании необходимости выполнения хирургического вмешательства чувствительность разработанной модели снижалась до 57%, что недостаточно для применения в клинической практике.
Хирургическое лечение МКБ можно разделить на три основных вида: дистанционная литотрипсия (ДЛТ), контактная уретеролитотрипсия (КУЛТ) и перкутанная нефролитотрипсия (ПНЛ). Kadlec и соавт. разработали нейронную сеть, которая позволяет прогнозировать результаты различных эндоурологических операций (ПНЛ, КУЛТ, ДЛТ) [30]. В исследование были включены 382 пациента с различными локализациями камней. Модель предсказывала отсутствие камней (определяемое как отсутствие камней более 4 мм по данным КТ) с чувствительностью 75,3%. При этом, специфичность прогнозирования повторного вмешательства составила 98,3% при чувствительности 30%. Это исследование заложило основу для разработки подобных прогностических номограмм в будущем.
Aminsharifi и соавт. разработали алгоритм прогнозирования исходов после ПНЛ на основе машинного обучения [31]. Результаты обследований, периоперационные и интраоперационные данные 200 пациентов были использованы в качестве входных данных для оценки состояния без резидуальных камней и необходимости переливания крови. Нейронная сеть разрабатывалась с использованием метода 10-проходной перекрестной проверки. Входной слой представлен 25 нейронами, каждый из которых репрезентировал одну из предоперационных переменных. Выходной слой состоял из шести узлов, означающих послеоперационные исходы. Архитектура разработанного алгоритма представлена на рисунке 10 [31].
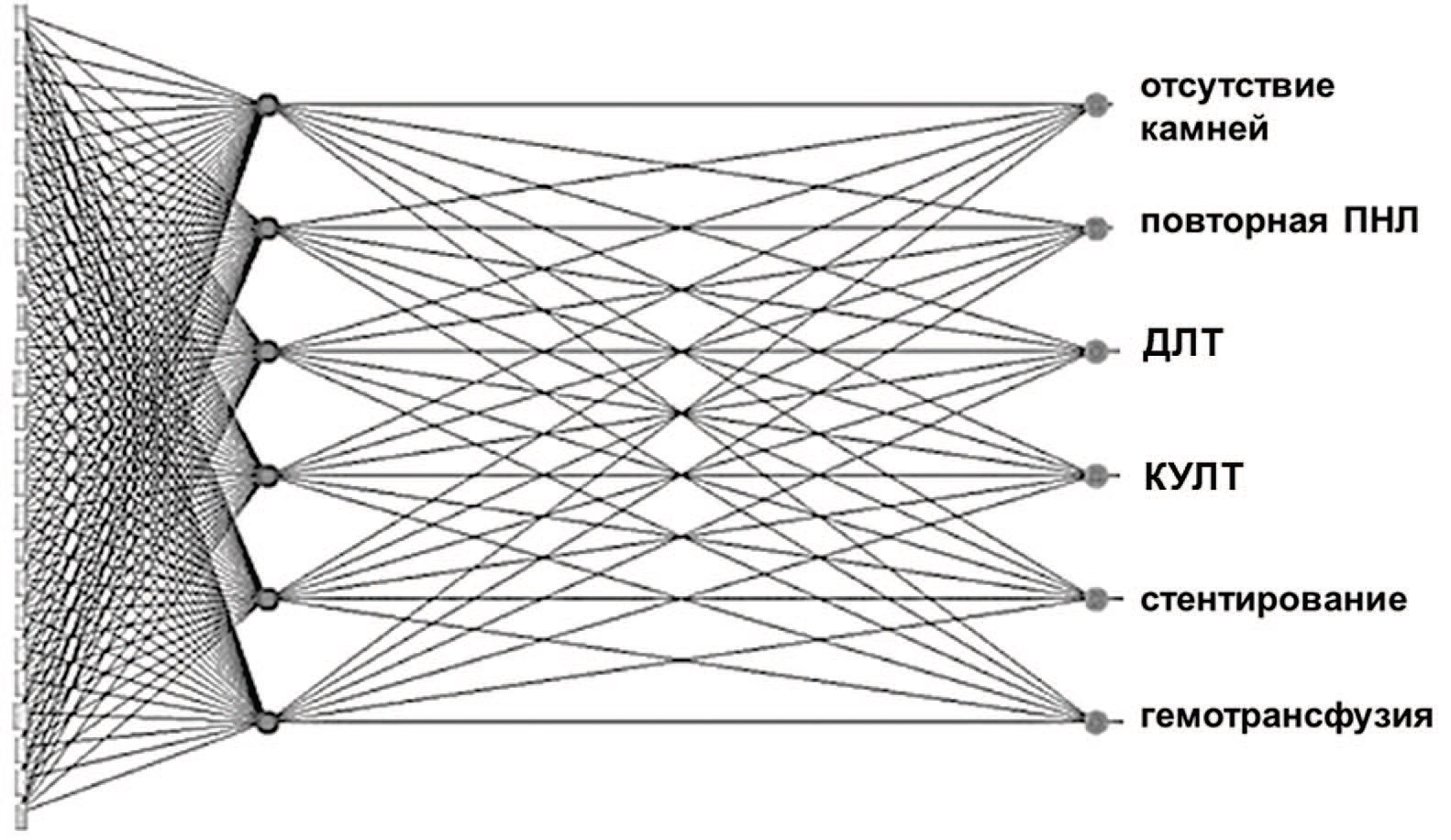
Рис. 10. Архитектура алгоритма для прогнозирования клинических исходов после индексного вмешательства [26]
Fig. 10. Schematic algorithm architecture for predicting clinical outcomes after the index intervention [26]
Разработанная нейросеть обладает высокой чувствительностью при прогнозировании исходов ПНЛ, в частности, 92% для SFR, 97% для прогнозирования потребности в повторной ПНЛ, 82% для дополнительной ДЛТ и 91% для дополнительной КУЛТ.
Shabaniyan и соавт. использовали алгоритмы машинного обучения для прогнозирования послеоперационных исходов у пациентов с МКБ [32]. Для разработки системы поддержки принятия решения использованы следующие методы: метод опорных векторов, многослойный перцептрон, метод ближайших соседей, квадратичный дискриминантный анализ. Сбор данных 254 пациентов выполнялся проспективно. В исследование включены предоперационные, интраоперационные и послеоперационные параметры. При этом 194 (76,4%) пациентам была успешно выполнена ПНЛ. Повторная ПНЛ потребовалась 12 пациентам (4,7%), ДЛТ – 15 пациентам (5,9%) и уретероскопия – 27 пациентам (10,6%) соответственно. У 67 (26,4%) больных отмечена длительное подтекание мочи, которое потребовало установки мочеточникового стента. Значительная кровопотеря зафиксирована у 58 (22,8%) пациентов, что потребовало проведение гемотрансфузии. Для повышения эффективностей моделей выполнено уменьшение размерности, ориентированное на уменьшение числа избыточных, неинформативных признаков путем применения оберточного метода последовательного выбора признаков (Sequential Forward Selection, SFS) и линейного дискриминанта Фишера. Интеграция линейного дискриминанта Фишера и SFS привела к улучшению точности классификации более чем на 6%, что является значимым для клинико-диагностического и лечебного процессов, но негативным образом повлияло на специфичность. Алгоритмы, разработанные с использованием метода опорных векторов, были наиболее точными при прогнозировании исходов после ПНЛ.
Gomha и соавт. сравнили ИНС с логистической регрессией для прогнозирования статуса отсутствия камней после ДЛТ [33]. Статус без камней был определен как отсутствие остаточных камней при обзорной или контрастной рентгенографии через 3 месяца. Характеристики были собраны по 984 случаям. Обе модели прошли обучение на 688 случаях. В 93,3% ИНС показала, что длина камня, его расположение, использование стента и ширина камня были наиболее важными исходными данными для сравнения логистической регрессии с ИНС. По этим показателям ИНС (87%) имела более точный прогноз по сравнению с логистической регрессией (62%).
Poulakis и соавт. использовали ИНС для прогнозирования результатов ДЛТ, при дроблении камней нижней чашечки, с использованием ретроспективного набора данных 680 пациентов, достигнув точности 92% [34]. Предикторы отхождения камней включали характер уродинамики в почке, за которым следуют чашечно-лоханочный угол, индекс массы тела (ИМТ) и размер камня.
Hamid A и соавт. взяли данные 60 пациентов, у которых ДЛТ был успешно использован для фрагментации камней, и использовал их для обучения ИНС, а затем применили его к 22 пациентам для прогнозирования количества ударных волн, необходимых для адекватной фрагментации [35]. Общая точность прогноза составила 75% и показала, что ИНС может идентифицировать пациентов, которые вряд ли получат какоелибо преимущество от ДЛТ, и что дальнейшие исследования могут улучшить точность прогноза.
Seckiner и соавт. использовали методы машинного обучения для точного прогнозирования результатов после ДЛТ камней почек и мочеточников [36]. Всего в исследование было включено 203 пациента. В качестве входных данных использовали пол, одиночные или множественные конкременты, локализацию конкремента, угол между нижней чашечкой и проксимальным сегментом мочеточника, гидронефроз, размер остаточных камней после ДЛТ, возраст, количество сеансов ДЛТ, плотность камня и креатинин. В структуру сети было введено 16 входных значений нейронов: восемь для двух промежуточных слоев и один – на выходном слое (рис. 11) [36]. Данное исследование подтвердило, что формирование двух промежуточных слоев нейронов рационально для оптимального обучения разработанного алгоритма. Разработанный алгоритм достиг 99,25% точности прогнозирования результатов лечения после ДЛТ в обучающей группе. При этом точность прогнозирования в проверочной выборке и тестовой выборке составила 85,48% и 88,70% соответственно.
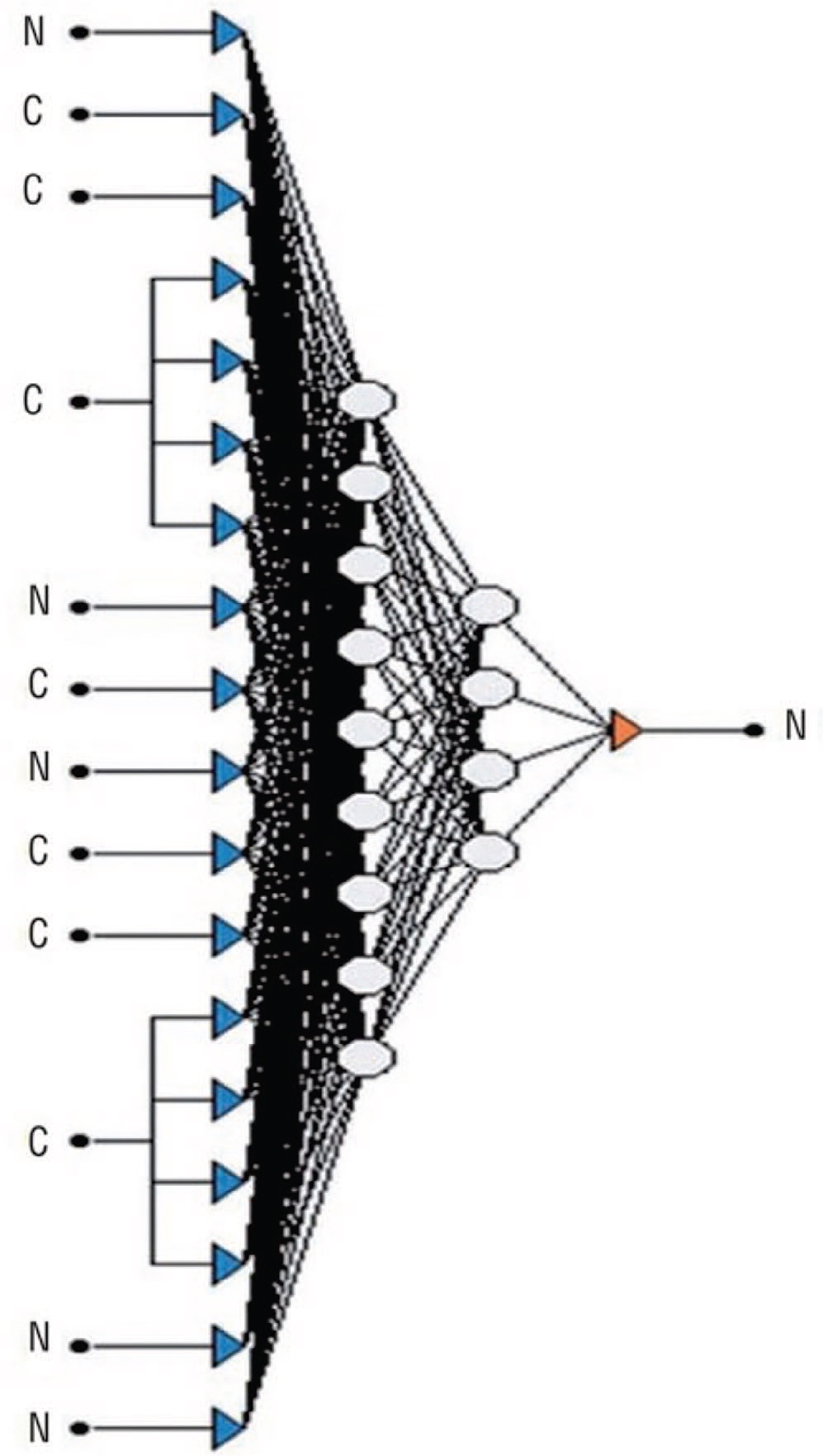
Рис. 11. Архитектура использованного алгоритма [29]
Fig. 11. Schematic architecture of the proposed algorithm [29]
Аналогичный результат в точности прогнозирования клинических исходов был продемонстрирован исследовательской группой под руководством Choo [37]. Успешным считалось лечение после однократной ударно-волновой литотрипсии с отсутствием резидуальных камней или остаточных фрагментов камней менее 2 мм по данным КТ или рентгенограммы почек, мочеточников и мочевого пузыря через 2 недели после выполненного вмешательства. В рамках данного исследования были продемонстрированы перспективы применения алгоритма дерева решений, в котором каждый узел представляет собой проверку атрибута, а его ветви – возможные результаты. Каждый лист дерева представляет собой класс или решение после вычисления всех атрибутов. Использование данного метода позволило получить модель с прогностической точностью равной 92%.
Mannil и соавт. продемонстрировали высокий потенциал машинного обучения при прогнозировании результатов лечения на основе 3D текстурного анализа с использованием алгоритма случайного леса [38]. Прогностически значимыми переменными явились ИМТ, исходный размер камня и расстояние от камня до кожи со значением AUC равным 0,68, 0,58 и 0,63 соответственно. Классификатор RandomForest и характеристики по 3D текстурному анализу продемонстрировали AUC равный 0,79. Включение клинических переменных в модель позволило увеличить точность распознавания до 0,85.
ЗАКЛЮЧЕНИЕ
Большинство представленных исследований не демонстрируют высоких показателей метрик, достаточных для клинического применения, что во многом обусловлено использованием упрощенных моделей ML и малой выборкой данных для обучения. Модели с использованием методов многослойных искусственных нейронных сетей и сверточных нейронных сетей демонстрируют наиболее перспективные результаты. Вероятно, что решения на их основе имеют наибольший потенциал для последующей реализации. Использование больших данных на совокупности разнородных показателей позволит существенно улучшить прогностическую точность моделей профилактики, метафилактики, а также выбора оптимального метода лечения пациентов с МКБ. В связи со сложностью учета значимых механизмов камнеобразования и, как следствие, низкой эффективностью профилактики и метафилактики, особенно актуальной представляется разработка методов интеллектуального анализа (нейронные сети, искусственный интеллект, машинное обучение) для создания персонифицированных моделей профилактики и метафилактики мочекаменной болезни, используя не только клинические и лабораторные данные пациента, но и большое разнообразие демографических, климатических, социальных, диетических и других факторов.
ЛИТЕРАТУРА
1. Global Burden of Disease Collaborative Network. Global Burden of Disease Study 2019 (GBD 2019) Disease and Injury Burden 1990-2019. Seattle, United States of America: Institute for Health Metrics and Evaluation (IHME) 2020.
2. Wang Z, Zhang Y, Zhang J, Deng Q, Liang H. Recent advances on the mechanisms of kidney stone formation (Review). Int J Mol Med 2021 Aug;48(2):149. https://doi.org/10.3892/ijmm.2021.4982.
3. Morgan MS and Pearle MS: Medical management of renal stones. BMJ 352: i52, 2016
4. Liu Y, Chen Y, Liao B, Luo D, Wang k, Li H, et al Epidemiology of urolithiasis in Asia Asian. J Urol 2018(5):205–14.
5. Safdar OY, Alzahrani WA, Kurdi MA, Ghanim AA, Nagadi SA, Alghamdi SJ, Zaher ZF, Albokhari SM. The prevalence of renal stones among local residents in Saudi Arabia. J Family Med Prim Care 2021 Feb;10(2):974-977. https://doi.org/10.4103/jfmpc.jfmpc_262_20.
6. Куликовский В.Ф., Шкодкин С.В., Батищев С.А., Невский А.А., Фиронов С.А., Золотухин Д.А. и др. Современные представления об эпидемиологии и патогенезе уролитиаза. Научный результат. Медицина и фармация 2016;2(4):4–12. [Kulikovsky V.F., Shkodkin S.V., Batishchev S.A., Nevsky A.A., Fironov S.A., Zolotukhin D.A. and etc. Modern concepts of the epidemiology and pathogenesis of urolithiasis. Nauchnyy rezul’tat. Medicine and pharmacy = Meditsina i farmatsiya 2016;2(4):4–12. (in Russian)]. https://doi.org/10.18413/2313-8955-2016-2-4-4-12.
7. D’Costa MR, Haley WE, Mara KC, Enders FT, Vrtiska TJ, Pais VM, Jacobsen SJ, McCollough CH, Lieske JC, Rule AD. Symptomatic and Radiographic Manifestations of Kidney Stone Recurrence and Their Prediction by Risk Factors: A Prospective Cohort Study. JASN Jul 2019;30(7):1251-1260; https://doi.org/10.1681/ASN.2018121241.
8. Ferraro PM, Curhan GC, D'Addessi A, Gambaro G. Risk of recurrence of idiopathic calcium kidney stones: analysis of data from the literature. J Nephrol 2017(30):227.
9. Борисов Д.Д., Кульнев С.В., Севрюков В.В. Применение искусственного интеллекта при организации лечебно-диагностических мероприятий. Известия российской военно-медицинской академии 2019;38(4):122-125. [Borisov D.D., Kulnev S.V., Sevryukov V.V. The use of artificial intelligence in the organization of medical and diagnostic measures. Russian Military Medical Academy Reports = Izvestiya rossijskoj voenno-medicinskoj akademii 2019;38(4):122-125. (in Russian)]. https://doi.org/10.17816/rmmar26037.
10. Moher D, Altman DG, Liberati A, Tetzlaff J. PRISMA statement. Epidemiology 2011;22(1):128.
11. Keoghane S, Walmsley B, Hodgson D. The natural history of untreated renal tract calculi. BJU Int 2010(105):1627. https://pubmed.ncbi.nlm.nih.gov/20438563.
12. Straub M, Strohmaier WL, Berg W, Beck B, Hoppe B, Laube N, et al. Diagnosis and metaphylaxis of stone disease. Consensus concept of the National Working Committee on Stone Disease for the upcoming German Urolithiasis Guideline. World J Urol 2005(23):309.
13. Ananthakrishnan L, Duan X, Xi Y, Lewis MA, Pearle MS, Antonenlli JA, et al. Duallayer spectral detector CT: non-inferiority assessment compared to dual-source dual energy CT in discriminating uric acid from non-uric acid renal stones ex vivo. Abdom Radiol 2018(43):3075–81.
14. Liden M. A new method for predicting uric acid composition in urinary stones using routine single energy. Urolithiasis 2018(46):325–33.
15. Fitri LA, Haryanto F, Arimura H, YunHao C, Ninomiya K, Nakano R. Automated classification of urinary stones based on microcomputed tomography images using convolutional neural network. Physica Medica 2020;(78):201–208. https://doi.org/10.1016/j.ejmp.2020.09.007.
16. Black KM, Law H., Aldoukhi, A, Deng J. and Ghani KR. Deep learning computer vision algorithm for detecting kidney stone composition. BJU Int 2020(125):920-924.
17. Jendeberg J, Thunberg P, Lide n M. Differentiation of distal ureteral stones and ́ pelvic phleboliths using a convolutional neural network. Urolithiasis 2020. https://doi.org/10.1007/s00240-020- 01180-z.
18. Verma J, Nath, M, Tripathi P. Analysis and identification of kidney stone using Kth nearest neighbour (KNN) and support vector machine (SVM) classification techniques. Pattern Recognit Image Anal 2017(27):574–580. https://doi.org/10.1134/ s1054661817030294.
19. Nithya A, Appathurai A, Venkatadri N, Ramji DR, Anna Palagan C. Kidney disease detection and segmentation using artificial neural network and multi-kernel k-means clustering for ultrasound images. Meas J Int Meas Confed 2020;149. https://doi.org/10.1016/j.measurement.2019.106952.
20. Viswanath K., Gunasundari R. VLSI Implementation and Analysis of Kidney Stone Detection from Ultrasound Image by Level Set Segmentation and MLP-BP ANN Classification. In: Dash S., Bhaskar M., Panigrahi B., Das S. (eds) Artificial Intelligence and Evolutionary Computations in Engineering Systems. Advances in Intelligent Systems and Computing 2016(394). Springer, New Delhi. https://doi.org/10.1007/978-81-322-2656-7_19.
21. Parakh A, Lee H, Lee JH, Eisner BH, Sahani DV, Do S. Urinary Stone Detection on CT Images Using Deep Convolutional Neural Networks: Evaluation of Model Performance and Generalization. Radiol Artif Intell 2019 Jul 24;1(4):e180066. https://doi.org/10.1148/ryai.2019180066.
22. Hokamp NG, Lennartz S, Salem J, dos Santos DP, Heidenreich A, Maintz D, Haneder S. Dose independent characterization of renal stones by means of dual energy computed tomography and machine learning: an ex-vivo study. Eur Radiol 2020;30(3):1397–404.
23. Cloutier J, Villa L, Traxer O, Daudon M. Kidney stone analysis: «Give me your stone, I will tell you who you are!». World J Urol 2015;33(2):157–69.
24. Kriegshauser JS, Silva AC, Paden RG, He M, Humphreys MR, Zell SI, et al. Ex vivo renal stone characterization with single-source dual-energy computed tomography: a multiparametric approach. Acad Radiol 2016;23(8):969–76.
25. Onal EG, Tekgul H. Assessing kidney stone composition using smartphone microscopy and deep neural networks. BJUI Compass 2022;1–6. https://doi.org/10.1002/bco2.1376ONALANDTEKGUL.
26. Chiang D, Chiang HC, Chen WC, Tsai FJ. Prediction of stone disease by discriminant analysis and artificial neural networks in genetic polymorphisms: a new method. BJU Int 2003(91):661–666. An interesting study of the genetic determinants of urolithiasis using ANNs.
27. Tanthanuch M, Tanthanuch S. Prediction of upper urinary tract calculi using an artificial neural network. J Med Assoc Thai 2004(87):515–518. An interesting study that includes an introduction to the ANN mathematics.
28. Batinic D, Milosevic D, Blau N. Value of the urinary stone promoters/ inhibitors ratios in the estimation of the risk of urolithiasis. J Chem Inf Comput Sci 2000(40):607-610.
29. Cummings JM, Boullier JA, Izenberg SD. Prediction of spontaneous ureteral calculous passage by an artificial neural network. J Urol 2000(164):326-328.
30. Kadlec A, Ohlander S, Hotaling J, Hannick J, Niederberger C, Turk TM. Nonlinear logistic regression model for outcomes after endourologic procedures: a novel predictor. Urolithiasis 2014(42):323-7.
31. Aminsharifi A, Irani D, Pooyesh S, Parvin H, Dehghani S, Yousofi K, et al. Artificial neural network system to predict the postoperative outcome of percutaneous nephrolithotomy. J Endourol 2017;31(5):461–467. https://doi.org/10.1089/ end.2016.0791.
32. Shabaniyan T, Parsaei H, Aminsharifi A, Movahedi MM, Jahromi AT, Pouyesh S, Parvin H. An artificial intelligence-based clinical decision support system for large kidney stone treatment. Australas Phys Eng Sci Med 2019 Sep;42(3):771-779. https://doi.org/10.1007/s13246-019-00780-3.
33. Gomha MA, Sheir KZ, Showky S, Abdel-Khalek M, Mokhtar AA, Madbouly K. Can we improve the prediction of stone-free status after extracorporeal shock wave lithotripsy for ureteral stones? A neural network or a statistical model? J Urol 2004(172):175–179.
34. Poulakis V, Dahm P, Witzsch U, De Vries R, Remplik J, Becht E. Prediction of lower pole stone clearance after shock wave lithotripsy using an artificial neural network. J Urol 2003;169(4):1250–6.
35. Hamid A, Dwivedi US, Singh TN, Kishore MG, Mahmood M, Singh H. Artificial neural networks in predicting optimum renal stone fragmentation by extracorporeal shock wave lithotripsy: a preliminary study. BJU Int 2003;91(9):821–4.
36. Seckiner I, Seckiner S, Sen H, Bayrak O, Dogan K, Erturhan S. A neural network– based algorithm for predicting stone – free status after ESWL therapy. Int Braz J Urol 2017;43(6):1110–1114. https://doi.org/10.1590/s1677-5538.ibju.2016.0630.
37. Choo MS, Uhmn S, Kim JK, Han JH, Kim DH, Kim J. A Prediction Model using machine learning algorithm for assessing stone-free status after single session shock wave lithotripsy to treat ureteral stones. J Urol 2018;200(6):1371–7.
38. Mannil M, von Spiczak J, Hermanns T, Poyet C, Alkadhi H, Fankhauser CD. Threedimensional texture analysis with machine learning provides incremental predictive information for successful shock wave lithotripsy in patients with kidney stones. J Urol 2018;200(4):829-36.
39. Langkvist M, Jendeberg J, Thunberg P, computed Loutfi A, Liden M. Computer-aided detection of ureteral stones in thin-slice tomography volumes using Convolutional Neural Networks. Comput Biol Med 2018(97):153–160. https://doi.org/10.1016/j.compbiomed.2018.04.021.
40. Ishioka J, Kobayashi M, Okuno T, et al. Computer-aided diagnosis with a convolutional neural network algorithm for automated detection of urinary tract stones using kub. J Urol 2019;201(4):e845.
41. Krishna KD, Akkala V, Bharath R, Rajalakshmi P, Mohammed AM, Merchant SN, Desai UB. Computer aided abnormality detection for kidney on FPGA based IoT enabled portable ultrasound imaging system. Irbm 2016;37(4):189–197. https://doi.org/10.1016/10.1016/j.irbm.2016.05.001.





































