ВВЕДЕНИЕ
В последнее время активно развитие получила цифровая патология – внедрение цифровых технологий в патологоанатомическую службу [1]. Базой для изменения специальности в сторону цифровой патологии становится метод Полного сканирования стекол или Whole slide imaging (WSI), позволяющий перевести изображения патологоанатомических препаратов в цифровой формат [2]. Для сканирования препаратов и работы с ними необходимо наличие целой системы, включающей в себя микроскоп, осуществляющий процесс сканирования, программное обеспечение, производящее управление микроскопом и работу с данными, а также сервер, на котором происходит накопление оцифрованных данных. Такие системы позволяют получить доступ к патологоанатомическим препаратам из любой точки и открывают новые возможности для развития как фундаментальной сферы патологической анатомии, так и клинического патологоанатомического анализа и диагностики.
Необходимость в сканирующих системах определяется не только развитием цифровой патологии как части новых медицинских технологий, но и напрямую связана с дефицитом патологоанатомов. По данным аналитического доклада о состоянии патологоанатомической службы РФ, за 2020 год укомплектованность штатов специалистами составила 78,9%, а средняя суммарная нагрузка в расчете на одного врача-патологоанатома составила 4,36 ставочных нормы. Одновременно с высокой нагрузкой на специалистов наблюдается низкие показатели обеспеченности основным технологическим оборудованием – средний показатель 43,5%, средний показатель числа устаревшего оборудования составил 23,2% [3]. Значительная нагрузка на врачей-патологоанатомов, недостаточность оснащение патологоанатомических штатов характеризуют необходимость в изменении работы специалистов и требуют внедрения новых технологий, которые позволят оптимизировать и облегчить работу с патологоанатомическим материалом. Целью данной статьи стало проведение обзора имеющихся на международном и российском рынке решений для сканирования морфологических материалов и сфер применения этих решений.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск статей производился в базе данных Pubmed. Поиск по запросам «microscopes pathology», «digital pathology», «whole-slide imaging», «digital scanning», «whole-slide scanning», «digital histology», «WSI deep learning», «virtual microscopy». Поиск информации о сканирующих микроскопах проводился на сайтах разработчиков, в том числе из открытых источников на данных сайтах, таких как брошюры, а также сайте FDA. В ходе работы были найдены и включены в обзор данные о 23 системах сканирования микроскопических препаратов.
ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ОЦИФРОВАННЫХ ПРЕПАРАТОВ
FDA одобрило применение технологии сканирования гистопрепаратов для дальнейшего анализа и хранения на электронном носителе. Philips IntelliSite Pathology Solution (PIPS) позволяет переносить биопсийные препараты в электронный формат и сохранять в систему хранения в увеличении до x400. FDA провели оценку данных клинического исследования примерно 2000 кейсов биопсийных материалов. Исследование показало, что диагнозы, поставленные с использованием PIPS технологии, сравнимы с диагнозами, поставленными с помощью стандартного изучения препарата на предметном стекле [4, 5].
Важно отметить, что в литературе существуют два способа обозначения увеличения микроскопа, связанные с особенностями его устройства. Некоторые авторы для обозначения увеличения перемножают увеличения объектива и окуляра. Окуляр, как правило, на световом микроскопе имеет увеличение x10, и при просмотре микропрепаратов увеличение регулируется с помощью смены объективов. Данное устоявшееся обозначение увеличения имеет свои корни из сложившейся практики «ручной» оценки микропрепаратов специалистами. Однако сканерах полного сканирования используют обозначение увеличения в 10 раз меньше, что порождает недопонимание в литературе. таким образом, увеличение x40 сканера будет эквивалентно увеличению x400 светового микроскопа, при условии использования стандартного окуляра x10 и объектива x40.
Alexander D. Borowsky и соавт. провели сравнение первичных диагнозов, поставленных патологоанатомами с помощью технологии WSI и стандартными методами. В исследование вошли 2045 клинических случаев и 5849 гистопрепаратов, оценку которых проводили 19 патологоанатомов как с помощью WSI, так и с использованием светового микроскопа. Время, затраченное на изучение препарата, а также возможные несоответствия поставленных диагнозов были примерно одинаковыми в обоих случаях, и исследователи не выявили статистически значимых различий в использовании обеих технологий. Клинические случаи, выбранные для исследования, были согласованы с FDA как наиболее часто встречающиеся в медицинской практике. Последовательность клинических случаев и применения WSI или светового микроскопа были случайны для каждого специалиста. Результаты исследования показали, что использование новой технологии WSI и постановка первичного гистологического диагноза возможна с той же точностью, что и при использовании стандартного метода оценки гистопрепаратов на световом микроскопе, что дает возможность внедрения новых технологий при неизменном качестве работы специалистов [6].
Аналогичное мультицентровое слепое рандомизированное исследование было проведено Mukhopadhyay и соавт. для доказательства гипотезы об отсутствии превосходства световой микроскопии над WSI технологией оценки изображений. В исследовании был проведен анализ 1992 клинических случаев – 3390 стекол и 3390 цифровых изображений, включающих в себя биопсию, препараты гематоксилин-эозин, иммуногистохимия и специальные окраски. Клинические случаи включали в себя ткани из различных систем органов – дыхательной, мочеполовой, пищеварительной, эндокринной, лимфатической и т.д. Анализ цифровых изображений и предметных стекол производился 16 патологами, сканирование препаратов производилось с помощью Philips IntelliSite Pathology Solution. Результаты показали наибольшее различие между диагнозами, поставленными с помощью анализа WSI и стандартным методом, составило 0,4%, а среди отдельных систем органов наибольшее различие по тем же критерием обнаружили в оценке патологий эндокринной системы – 1,8%. Кроме того, в оценке патологий печени, желчных протоков и слюнных желез WSI показала лучшие результаты, чем световая микроскопия. Таким образом, данное исследование подтвердило отсутствие превосходства постановки первичного диагноза с помощью световой микроскопии над WSI. Включение в исследование различных видов клинических случаев из большинства систем органов позволяет применить данные результаты практически ко всем видам патологоанатомической диагностики. Результаты данной работы показывают возможности внедрения диагностики с применением цифровых технологий в рутинную клиническую практику [7].
В настоящее время многие исследования, дизайн которых включает в себя работу с гистологическими препаратами, используют отсканированные гистоизображения. Так, в работе по исследованию иммунотерапевтической регуляции микросреды опухоли при раке предстательной железы сканирование и анализ изображений позволили произвести подсчет иммуноцитов. Поскольку у пациентов с высоким риском развития рака предстательной железы наблюдается повышенная плотность опухольинфильтрирующих B-клеток в препаратах простатэктомии, авторы статьи предложили производить оценку эффективности действия неоадъювантов по снижению содержания инфильтрирующих CD20+ Bклеток в биопсии простаты. после подготовки иммуногистохимических препаратов предстательной железы проводилось их сканирование с помощью Aperio AT2 system (Leica BioSystems), калибровка освещенности предметного стекла производилась автоматизированно перед началом сканирования. Далее производился анализ полученных изображений после определения патологоанатомами границ опухоли. Оценка уровня инфильтрации ткани производилась по интенсивности окрашивания участков с помощью деконволюционного алгоритма. Таким образом, исследование показало возможности точной оценки результатов иммуногистохимии на основе отсканированных изображений, что позволяет утверждать о возможности использования технологии для сканирования иммуногистохимических препаратов и дальнейшей работы с ними [8].
В исследовании Sethi A. и соавт. была оценена возможность использования цифровых снимков биопсии предстательной железы. Препараты. с окраской гематоксилин-эозин были отсканированы на увеличении x20 с помощью Aperio Scanscope CS. Для определения границ ткани производилась цветовая сегментация изображения. Кроме того, была создана библиотека объектов гистологического изображения, включающая в себя несколько видов клеток – эпителиальные, стромальные и эпистромальные, и ядра эпителиальных клеток. Обучение компьютерного зрения дифференциации элементов ткани позволило применить данный алгоритм для оценки эффективности терапии ингибитором 5альфа-редуктазы [9].
В работе Ali и соавт. также производился подсчет плотности инфильтрирующих лимфоцитов после сканирования препаратов опухоли молочной железы с окраской гематоксилин-эозин. Целью данного исследования является сравнение работы патологоанатома и «вычислительной патологии», поскольку авторы исследования предполагают, что автоматизация процесса не приведет к ухудшению качества чтения патологоанатомического изображения. В ходе работы были использованы гистологические данные из клинического многоцентрового рандомизированного контролируемого исследования ARTemis III фазы [10]. Сканирование гистологических изображений тканей до и после хемотерапии производилось с помощью Hamamatsu Nanozoomer (Hamamatsu City, Shizuoka Pref., Japan). Далее авторы работы производили анализ изображений. «Вычислительная патология» представлена алгоритмом, который определяет ядро клетки и производит классификацию клетки на одну из трех категорий – раковая, стромальная или лимфоцит. Машинное обучение производилось на около 1000 объектов каждой категории. Далее, после классификации клеток, производилась оценка их плотности. Исследование подтвердило роль плотности лимфоцитов как предиктора патологического полного ответа, что подтверждает использование цифровой патологии как стандарта гистопатологической оценки образцов тканей, поскольку результаты данного независимого исследования совпали с результатами ARTemis [11].
WSI метод применим и к определению карциномы плоских клеток пищевода. Комбинация технологии WSI и программы обработки изображений позволяет эффективно определять различные иммуномаркеры в тканевых матрицах [12].
Технологии сканирования и анализа гистологических изображений применяются в оценке эффективности иммунотерапии опухолей. В данном исследовании применяется подсчет и изучение локализации CD8+ опухоль-инфильтрирующих лимфоцитов. После подготовки иммуногистохимических препаратов было произведено их сканирование с помощью Aperio AT turbo сканера (Leica BioSystems, Wetzlar, Germany) на увеличении x20. Просмотр изображений осуществлялся с помощью программы Aperio ImageScope версия 12.1.0 (Leica BioSystems) или VeriTrova (Definiens, Munich, Germany). Области опухоли на препарате были выделены патологоанатомом. Авторы исследования по его результатам подтвердили возможность использования отсканированных изображений биопсии опухолей для анализа эффективности иммунотерапии в онкологии [13].
Ole-Johan Skrede и соавт. в исследовании по поиску маркеров исхода первичного колоректального рака совместили использования технологии WSI и глубокого машинного обучения. Сканирование препаратов, окрашенных гематоксилином и эозином производилось на двух сканерах – Aperio AT2 (Leica Biosystems, Germany) и NanoZoomer XR (Hamamatsu Photonics, Japan) при максимально возможном увеличении x40. Для обучения пяти нейронных сетей были использованы более 12 000 000 изображений от 4 когорт пациентов с различными стадиями колоректального рака для достижения репрезентативных результатов. Использование автоматизированного сканирования и анализа полученных изображений снижает субъективный аспект в постановке диагноза. Подобные патологоанатомические системы возможно использовать в будущем в специализированных лабораториях для стандартизации процесса, что позволит и исключить различия, связанные с неодинаковым выполнением этапов гистологического анализа, в том числе сканированием образцов. Развитию цифрового направления в патологии способствует увеличение количества цифровизированных лабораторий. Использование сканирования гистопрепаратов и их автоматического анализа потенциально исключает сложности, связанные с гетерогенностью опухолей, что повысит точность диагноза [14].
Сканирование флюоро-хромогенных иммуногистохимических изображений технологией WSI проводилось в исследовании Minichromosome Maintenance Protein 2 (MCM2) как биомаркера рака молочной железы. Оцифровка проводилась прибором Slide Strider (Jilab Inc., Tampere, Finland) последовательным сканированием под ярким полем и при флюоресценции на увеличении x20. Отсканированные изображения сохранялись как многослойные JREG2000 изображения и хранились на общем сервере. Авторы исследования показали, что использование анализа цифровых изображений флюорохромогенной иммуногистохимии позволяет точно определять наличие специфичных к карциноме белков MCM2-LI по одному срезу опухоли [15].
Другим применением технологии полного сканирования препарата является обучение будущих патологоанатомов в университете. Andrew John Evans и соавт. предложили применение цифровой патологии и WSI как инструмента для дистанционного обучения. В данном исследовании проводились дистанционные занятия, в течение которых клинические случаи разбирались на основе сканированных гистоизображений. Оценка понимания и усвоения материала, а также обратная связь о методе обучения проводились с помощью обсуждения в течение занятия и опросника после испытательного периода. Результаты показали, что 12 участников обозначили качество снимков как идентичное просмотру с помощью микроскопа, а остальные 3 участника посчитали качество WSI лучше, чем в стандартном варианте гистологического исследования. Кроме того, участники исследования посчитали наиболее подходящим сканирование изображения на увеличении x40. Плюсами такого метода обучения является сохранение блока ткани и использования одного среза, который благодаря цифровизации может быть передан в любую точку и может быть просмотрен в любое время. Авторы исследования предполагают, что обучение патологоанатомов с помощью WSI технологий и цифровой патологии получит дальнейшее развитие вследствие очевидных преимуществ относительно стандартного обучения с помощью светового микроскопа [16].
Таблица 1. Возможности стандартной микроскопии и WSI микроскопии
Table 1. Capabilities of standard microscopy and WSI microscopy
| Световой микроскоп Light microscope |
Микроскоп-сканер Microscope-scanner |
|
|---|---|---|
| Возможность просмотра изображения / Image viewing opportunities | + | + |
| Сохранение данных / Data saving | - | + |
| Анализ и сравнение данных, в т.ч. с использованием искусственного интеллекта / Data analysis and comparison including via artificial intelligence |
- | + |
| Работа с большими объемами данных / Work with big data | - | + |
| Работа с изображением (выделение структур) / Working with images (structures highlighting) | - | + |
| Передача данных / Data transfer | + - | + |
| Возможность анализа данных несколькими специалистами одновременно / Opportunity of data analysis by several specialists simultaneously |
+ - | + |
| Проведение консилиумов. Взаимодействие преподавателей со студентами / Concilium holding. Teachers and students interactions |
+ - | + |
Аналогичное проспективное рандомизированные перекрестное исследование было проведено для сравнения качества обучения студентов при использовании световой и «виртуальной» микроскопии. Участники исследования – 67 студентов, были разделены на две группы. Первая группа изучала микроскопические структуры с помощью светового микроскопа, вторая – посредством изучения видео препарата, выводимого на экран преподавателем. Во второй части исследования группы менялись способами обучения. Оценка качества знаний проводилась с помощью тестов и практического экзамена. Результаты тестов оказались лучше (на 6 баллов и 1 балл соответственно по двум тестам) у студентов, изучавших темы с помощью виртуальной микроскопии. 92% студентов предпочли использование виртуальной микроскопии, 98% студентов сообщили, что данный вид изучения препаратов является эффективным для обучения. Таким образом, внедрение способов обучения с помощью виртуальной микроскопии является перспективным направлением, и изменения в методологии преподавания предоставит студентам необходимый и более высокий уровень, в сравнении со стандартными методами, необходимый для клинической практики [17].
МИКРОСКОПЫ И УСТРОЙСТВА, НЕОБХОДИМЫЕ ДЛЯ ОСУЩЕСТВЛЕНИЯ СКАНИРОВАНИЯ
Очевидные преимущества хранения гистологических изображений на электронном носителе и возможности их просмотра на экране электронного устройства, например, на экране компьютера, создают постоянный поиск наиболее подходящих и удобных способов оцифровки изображения. Одним из вариантов является оцифровка гистологических изображений без просмотра через микроскоп. В течение развития цифровой патологии были использованы различные варианты просмотра изображений препаратов. Первым этапом стало использование проекторов, прикрепленных к микроскопу вместо окуляра. Вторым этапом стало использование аналоговых камеры и телевизора, что позволяло проводить обсуждения полученных изображений и гистологических структур как патологоанатомами, так и преподавателями и студентами. Ограничениями данных вариантов стало низкое качество изображения, связанное как с низким качеством камеры, так и искажением при выводе изображения на экран телевизора или проектором. Другой проблемой являлось отсутствие сохранения и передачи выведенной информации, что решилось в двух следующих этапах: использовании монитора компьютера и современного телевизора. Обязательной частью в таком случае является оцифровка изображений с помощью автоматизированных микроскопов или так называемых сканеров, что позволяет сохранять, просматривать и вносить аннотации при работе с изображением. Передача изображения позволяет работать патологоанатомам удаленно как из других городов или стран, так и из дома [18, 19].
Поскольку во всех перечисленных выше исследованиях и статьях важной частью являлись сканирование и оцифровка изображений, обязательным звеном между предметным стеклом и изображением на экране компьютера становятся микроскопы и сканеры. В настоящее время имеются конкретные решения, используемые для оцифровки изображения. Большая часть перечисленных ниже в обзоре микроскопов применяются в частных лабораториях, имеют высокую стоимость и не во всех странах имеют разрешение на применение в клинической практике.
МИКРОСКОПЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ СКАНИРОВАНИЯ ПАТОЛОГОАНАТОМИЧЕСКИХ ПРЕПАРАТОВ
Philips IntelliSite Pathology Solution (PIPS) в настоящее время является одобренным FDA для применения в клинической практике. Вместимость сканера до 300 стекол, а скорость сканирования до 60 слайдов в час с полем сканируемого изображения 15x15 мм. Используемое увеличение – 40x. Одним из значительных преимуществ данного сканера является возможность продолжения сканирования слайдов, даже при наличии ошибки при сканировании одного из стекол. Система включает в себя не только сканер, но и программное обеспечение и сервер для хранения оцифрованных гистологических изображений. Однако значительные размеры сканера (656 x 933 x 587 см) и масса 139 кг ограничивают применение сканера только в лабораториях и крупных ЛПУ [20].

Рис. 1. Philips IntelliSite Pathology Solution (PIPS). Источник: https://www.usa.
philips.com/healthcare/product/FDP0001/intellisite-ultra-fast-scanner
Fig. 1. Philips IntelliSite Pathology Solution (PIPS). Source: https://www.usa.
philips.com/healthcare/product/FDP0001/intellisite-ultra-fast-scanner
Наиболее широко на рынке сканеров представлены продукты Leica BioSystems [21]. Модели Aperio GT 450 DX System, Aperio GT 450, Aperio AT2, Aperio CS2, Aperio LV1, Aperio VERSA. Все представленные решения работают как светлопольные микроскопы, кроме Aperio VERSA, который позволяет производить сканирование иммунофлюоресцентных и FISH препаратов, а также иммерсионную микроскопию. Скорость сканирования у данной модели участка стекла 15x15 мм равняется 206 секундам на увеличении x20. Однако данный микроскоп в настоящее время не одобрен для использования в клинической практике и может быть использован только в исследовательских целях, как и Aperio LV1. Наибольшую вместимость – 400 стекол – имеют Aperio AT2 и Aperio AT Turbo. Остальные сканеры зарегистрированы как медицинские устройства для диагностики in vitro и могут применяться в лабораториях. Aperio Scanscope CS представляет собой сканер с вместимостью 5 стекол. Скорость сканирования одного участка 15x15 мм на увеличении 20x составляет не более 2 минут, а используемые увеличения – 20x и 40x. Кроме того, данный сканер одобрен FDA для использования в клинической практике и в научных исследованиях [22]. Как медицинские изделия в РФ зарегистрированы микроскопы Aperio AT и AT2 (ФСЗ 2012/13159), а также Leica SCN400 (РЗН 2013/1185).
https://www.leicabiosystems.com/digitalpathology/scan/aperio-lv1-ivd/"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_2.png" style="width:50%" />
Рис. 2. Aperio LV1 IVD. Источник:
https://www.leicabiosystems.com/digitalpathology/scan/aperio-lv1-ivd/
Fig. 2. Aperio LV1 IVD. Source: https://www.leicabiosystems.com/digital-pathology/scan/aperio-lv1-ivd/
Hamamatsu Nanozoomer (Hamamatsu City, Shizuoka Pref., Japan) представлены 4 сканерами, отличающимися вместимостью от 1 до 360 стекол и сканированием препаратов на стандартных увеличениях 20x и 40x. Преимуществом данных сканеров является наличие регистрации как медицинского устройства, в том числе и для использования на территории Российской Федерации [23]. Отличительной особенностью является наличие иммунофлюоресцентного варианта сканирования у модели NanoZoomer S60 Digital slide scanner C13210-01 [24]. Наибольшей скоростью сканирования обладает модель NanoZoomer S360 Digital slide scanner C13220-01, в которой сканирование изображений 15x15 мм на обоих вариантах увеличения занимается около 30 секунд, что дает данному сканеру значительное преимущество над аналогичными решениями в цифровой патологии [25]. Изображения сохраняются в формате JPEG в сжатом варианте, что может стать препятствием для качественного и полноценного анализа полученных изображений. В Российской Федерации в настоящее время имеется регистрация данных микроскопов как медицинских изделий.
https://nanozoomer.hamamatsu.com/jp/en/scanner/search/C13220-01/index.html"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_3.png" style="width:50%" />
Рис. 3. NanoZoomer S360 Digital slide scanner C13220-01. Источник:
https://nanozoomer.hamamatsu.com/jp/en/scanner/search/C13220-01/index.html
Fig. 3. NanoZoomer S360 Digital slide scanner C13220-01. Source:
https://nanozoomer.hamamatsu.com/jp/en/scanner/search/C13220-01/index.html
Slide Strider appliance (Jilab Inc., Tampere, Finland) представлена двумя вариантами микроскопов [26]. Slide Strider Ducenti представляет собой стационарный сканер вместимостью 200 стандартных стекол и с возможностью сканирования на увеличениях 10x, 20x и 40x. Скорость сканирования участка 15x15 мм – 2 минуты на одно стекло. Оцифрованные изображения сохраняются в формате JPEG2000. Возможно использование иммерсионной микроскопии, сканирование иммунофлюоресцентных микропрепаратов и флюоресцентной гибридизации in situ благодаря наличию эпифлюоресцентного модуля [27]. Slide Strider Octo меньше по размерам и обладает вместимостью до 8 стекол, однако обладает техническими характеристиками, аналогичными имеющимся у Slide Strider Ducenti [28].

Рис. 4. Slide Strider Ducenti. Источник: https://jilab.fi/wp-content/uploads/
2020/01/slidestrider.pdf
Fig. 4. Slide Strider Ducenti. Source: https://jilab.fi/wp-content/uploads/ 2020/01/slidestrider.pdf
Grundium предлагает компактные микроскопы Ocus®40 и Ocus®20, сканирующие по одному стеклу. Внешне данные сканеры сходны со световыми микроскопами, поскольку имеют предметный стол и объектив над ним. Размеры микроскопа составляют 18x18x19 см, масса 3,5 кг. Возможное увеличение x40 и x20 для каждого решения, скорость сканирования участка 15x15 мм составляет около 3 минут и 1 минуты соответственно для Ocus®40 и Ocus®20, изображения сохраняются в формате TIFF и SVS. На базе данного микроскопа совместно с Zoetis и Techcyte была создана система, используемая в ветеринарных клиниках, для сканирования и обнаружения паразитов в фекалиях животных с помощью искусственного интеллекта. Однако в настоящее время сканер Ocus®40 в США зарегистрирован только как исследовательский аппарат, не предназначенный для использования в клинической практике [29].
https://grundium.com"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_5.png" style="width:50%" />
Рис. 5. Grundium. Источник: https://grundium.com
Fig. 5. Grundium. Source: https://grundium.com
Сканеры uScopes представлены тремя сканерами с увеличением 20x, 40x и 60x соответственно. Вместимость каждого устройства – 1 слайд, скорость сканирования участка 15x15 мм на увеличении 20x составляет около 6 минут, на увеличении 40x – 22 минуты, 60x – около 49 минут. Время сканирования увеличивается при сканировании в HD. Данный микроскоп не зарегистрирован как медицинское устройство [30].
Аналогичным сканером является Glissando Desktop™ Scanner. Возможное увеличение является стандартным 20x или 40x [31]. Применение данного прибора так же возможно только в исследовательских целях, и не проведена регистрация как медицинского устройства.

Рис. 6. Glissando Desktop™. Источник: http://www.objectiveimaging.com/
Glissando/Glissando-Scanner.php
Fig. 6. Glissando Desktop™. Source: http://www.objectiveimaging.com/ Glissando/Glissando-Scanner.php
Meyer Instruments предлагают систему PathScan Enabler 5 для WSI. Первый вариант данного устройства был разработан в 1995 году. Поле сканирования 24.3 x 36.5 мм, а вместимость 2 предметных стекла. Получаемое после оцифровки изображение эквивалентно изображению на микроскопе при увеличении 4x, сохранение файлов возможно в TIFF и JPEG форматах. Авторы подчеркивают, что их сканер создан не для замены, а для дополнения существующих в настоящее время лабораторных микроскопов [32]. Однако информация о данном устройстве получена из открытых источников и не имеет данных о применении в клинической практике, с чем может быть связано отсутствие дальнейшего развития сканера и более новых решений на базе представленной разработки.
https://www.meyerinst.com/pathscan-enabler-5/"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_7.png" style="width:50%" />
Рис. 7. PathScan Enabler 5. Источник: https://www.meyerinst.com/pathscan-enabler-5/
Fig. 7. PathScan Enabler 5. Source: https://www.meyerinst.com/pathscan-enabler-5/
Автоматизированные цифровые системы микроскопии VisionTek® M6 и VisionTek® являются сканерами, позволяющими сканировать по 4 стекла на четырех (2.5x, 10x, 20x и 40x) и шести (2.5x, 5x, 10x, 20x, 40x, и 63x) вариантах увеличения соответственно. Система включает в себя не только сканеры, но и программное обеспечение для них, благодаря чему возможна работа с полученными оцифрованными изображениями. Удаленный просмотр изображений возможен не только после сканирования, но и на стадии предпросмотра загруженных в сканер стекол. Кроме того, данный сканер предполагает возможности использования как WSI, так и частичного сканирования изображения. В настоящее время сканеры могут быть использованы только для исследовательских целей и не имеют регистрации медицинского устройства [33]. Tissuegnostics – сканеры, в которых возможно применение светлопольной (стандартной) и конфокальной микроскопии. Разработчики данных микроскопов предлагают их использования для цитометрии, однако большой выбор устройств позволяет использовать все виды микроскопии, в том числе микроскопию иммуногистохимических препаратов. Время сканирования препарата 15x15 мм составляет около 2 минут [34].

Рис. 8. TissueFAXS CHROMA. Источник: https://tissuegnostics.com/products/
multispectral-cytometer/tissuefaxs-chroma
Fig. 8. TissueFAXS CHROMA. Source: https://tissuegnostics.com/products/ multispectral-cytometer/tissuefaxs-chroma
Huron Digital Pathology предлагают использование сканера TissueScope iQ. К его характеристикам относится высокая вместимость предметных стекол – полная загрузка сканера позволяет отсканировать 400 стандартных стекол или 200 двойных. Сканирование одного слайда 15x15 мм на увеличении 20x занимает менее 1 минуты. Кроме того, данный сканер совместим с DICOM стандартом. Одной из проблем анализа гистологических изображений является их большой размер, что в данной системе решено с помощью выделения участков интереса и присвоения им штрих-кодов. Кроме того, во время анализа изображений и выделенных патологоанатомами участков программа предоставляет специалистам аналогичные по анатомической структуре изображения с предполагаемыми диагнозами, что может использоваться как инструмент для помощи в постановке диагноза врачом [35]. Однако на данный момент описанная система сканирования и оцифровки так же может быть использована только для исследования и обучения, что ограничивает ее применение в клинической практике. Однако это не единственный сканер данной компании, и TissueScope™ LE имеет регистрацию CE-IVD.

Рис. 9. TissueScope iQ. Источник: https://www.hurondigitalpathology.com/ tissuescope-iq-2/
Fig. 9. TissueScope iQ. Source: https://www.hurondigitalpathology.com/ tissuescope-iq-2/
МЕКОС представляет линейку автоматизированных микроскопов российского производства, разделенных по целям их использования – анализ мазков, биологических жидкостей, гистологии и цитологии, на различные протозойные инвазии, бактериальную инфекцию. Система состоит из сканера и программы, анализирующей изображение, поэтому платформы-сканеры представлены двумя вариантами – МЕКОС-Ц2 и МЕКОС-Ц3, на базе которых возможно проведение вышеперечисленных видов анализа [36]. Характеристики сканера MECO-SCAN, используемого в данных системах, включают в себя возможность загрузки от 1 до 200 стекол в зависимости от варианта платформы. Скорость сканирования на увеличении 20x составляет 20-40 секунд, на 40x – 60-120 секунд. Отсканированные изображения конвертируются в DZI формат и загружаются на облачный сервер. Кроме того, имеется функция фиксации областей интереса, измерение и добавление аннотаций при анализе изображения [37]. Имеет регистрацию в РФ как медицинского устройства (ФСР 2011/10003).
https://www.mecos.ru"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_10.png" style="width:80%" />
Рис. 10. Комбайн МЕКОС. Источник: https://www.mecos.ru
Fig. 10. Harvester MEKOS. Source: https://www.mecos.ru
Zeiss Axioscan представляет микроскопы для лабораторной диагностики как в биомедицинской практике, так и для металлографии и исследования материалов. Наиболее актуальной моделью является ZEISS Axioscan 7. Данный сканер поддерживает светлопольную, флюоресцентную и поляризационную микроскопию, возможные увеличения 10x, 20x, 40x. Время сканирования участка 10x10 мм на увеличении 20x для светлопольной микроскопии составляет 1 минуту 13 секунд, для 4-хканальной флюоресцентной 5 минут 23 секунды. Вместимость сканера составляет от 12 до 100 стекол. Однако данная система не может быть использована в клинической практики, что связано с отсутствием соответствующей регистрации как медицинского изделия [38].

Рис. 11. ZEISS Axioscan 7. Источник: https://www.zeiss.com/microscopy/
int/products/imaging-systems/axioscan-for-biology.html
Fig. 11. ZEISS Axioscan 7. Source:
https://www.zeiss.com/microscopy/int/products/imaging-systems/axioscan-for-biology.html
Проведение высококачественной цифровой микроскопии возможно также и с помощью сканеров PANNORAMIC (3DHISTECH). Время сканирования одного стекла на увеличении x20 достигает 35 секунд, на увеличении 40x – 1 минута 35 секунд. При светлопольной микроскопии возможно использование увеличения до 80x, а при флюоресцентной – до 60x, что связано с наличием двух камер для разных вариантов сканирования. Система включает в себя программное обеспечение, которое поддерживает такие форматы файлов, как DICOM и Tiled TIFF [39]. Данные микроскопы имеют регистрацию в РФ как медицинские устройства – PANNORAMIC Desk (ФСЗ 2009/05312), PANNORAMIC Scan (ФСЗ 2009/05419) и PANNORAMIC Midi (ФСЗ 2009/05420).
https://www.3dhistech.com/research/pannoramic-digital-slide-scanners/pannoramic-250-flash-iii/"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_12.png" style="width:50%" />
Рис. 12. PANNORAMIC. Источник:
https://www.3dhistech.com/research/pannoramic-digital-slide-scanners/pannoramic-250-flash-iii/
Fig.12. PANNORAMIC. Source:
https://www.3dhistech.com/research/pannoramic-digital-slide-scanners/pannoramic-250-flash-iii/
VENTANA DP 200 (Roche) сканер является светлопольным цифровым сканером, Его вместимость составляет 6 стандартных предметных стекол, а сканирование осуществляется на увеличениях 20 и 40. При этом время сканирования является соответственно 49 и 85 секунд для каждого из увеличений при сканировании стандартного участка размером 15x15 мм. Преимуществами данного сканера является совместимость с DICOM стандартом, а также автоматический фокус во время сканирования, а также наличие маркировки CE-IVD, что позволяет использовать данный сканер как медицинское изделия для лабораторной диагностики. Возможно сканирование препаратов с окраской гематоксилин-эозин, специальными окрасками, цитологии и замороженных срезов [40, 41]. Аналогичный сканер данной компании VENTANA iScan HT имеет регистрацию в Росздравнадзоре – РЗН 2015/3509.

Рис. 13. VENTANA DP200 (Roche). Источник: https://diagnostics.roche.com/
global/en/products/instruments/ventana-dp-200.html
Fig. 13. VENTANA DP200 (Roche). Source: https://diagnostics.roche.com/
global/en/products/instruments/ventana-dp-200.html
Сканер SLIDEVIEW VS200 (Olympus) имеет вместительность до 210 стекол, а также возможность сканирования в 5 вариантах освещения – светлопольная, темнопольная, поляризационная, флюоресцентная и фазово-контрастная микроскопия. Возможна оцифровка каждого слайда в выбранном варианте микроскопии, а также имеется функция приоритетного сканирования при необходимости прерывания работы сканера для срочного сканирования отдельного стекла. В данных микроскопах также имеется система автофокусирования во время сканирования микропрепарата, что позволяет получить наиболее четкое изображение всех участков. Возможные варианты увеличения – 20x, 40x, 60x, 100x. В случае увеличения от 40x и более используется иммерсионная высокоразрешающая микроскопия. Изображение, полученное с помощью флюоресцентной микроскопии, корректируется с помощью TruSight Live [42].

Рис. 14. SLIDEVIEW. Источник: https://www.olympus-lifescience.com/en/
solutions-based-systems/vs200/
Fig. 14. SLIDEVIEW. Source: https://www.olympus-lifescience.com/en/solutionsbased-systems/vs200/
Сканеры Hospitex International представлены микроскопами для цитологии, осуществляющими сканирование препарата в светлом поле. Система CYTOfast Digital Vision включает в себя микроскоп, компьютер и программное обеспечение для анализа и подсчета клеток в препарате гинекологического мазка. Анализ включает в себя не только подсчет общего количества клеток, но и их классификацию и подсчет каждого типа. Сканирование образцов возможно на увеличении 40x, возможно последовательное сканирование до 4 стекол. Однако данная система микроскопии предполагает использование слайдов, подготовленных по запатентованной технологии Hospitex Nephelometric Smart, которая позволяет получать тонкие срезы гистопрепаратов для наиболее удобного проведения цитологического исследования с помощью искусственного интеллекта [43].
Другим вариантом сканера является система микроскопии M8 (Histo-Line Laboratories), которая включает в себя сканер и сопутствующие устройства, необходимые для просмотра оцифрованного изображения. Данный вариант сканера является компактным, по размерам аналогичен стандартному световому микроскопу, и может быть использован как для срочного сканирования замороженных срезов, так и для привычной оцифровки гистопрепаратов. Преимуществом данной системы является наличие CE-IVD регистрации как устройства для проведения лабораторных исследований [44].

Рис. 15. Система микроскопии M8. Источник: https://histoline.com/en/hlm8
Fig. 15. Система микроскопии M8. Source: https://histoline.com/en/hlm8
Сканер Da Vinci (DiaPath) представляет собой систему автоматизированного кассетного сканирования препаратов. Преимуществом данного устройства являются его небольшие размеры, а также возможность запоминания последней позиции при сканировании. Однако в настоящее время сканер имеет только маркировку CE, что показывает соответствие основным требованиям, предъявляемым к медицинским изделиям, однако не может быть использован для диагностики in vitro [45].
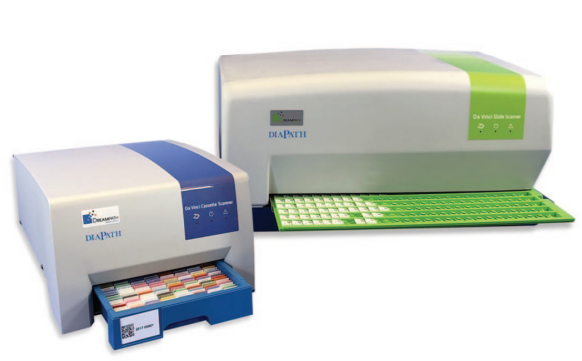
Рис. 16. Сканер Da Vinci (DiaPath). Источник: https://www.diapath.com/
news/linea-da-vinci-scanner-cassette-e-vetrini-84
Fig. 16. Сканер Da Vinci (DiaPath). Source: https://www.diapath.com/news/
linea-da-vinci-scanner-cassette-e-vetrini-84
WestMedica предлагает 3 варианта микроскопов – Vision Assist, Pro и Ultimate. Возможно сканирование от 1 до 200 слайдов в зависимости от используемой модели, что связано с вариантами загрузки слайдов в кассету. Увеличение для всех микроскопов 20x, модель Ultimate имеет дополнительно увеличение 10x. Сканирование возможно только с использованием светлопольной микроскопии, возможны как последовательный, так и случайный и безостановочный режимы работы. Не все модели могут быть использованы как медицинские устройства, что ограничивает возможности применения данных сканеров [46].
http://wm-vision.com/en/product/hema"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_17.png" style="width:50%" />
Рис. 17. Микроскопы WestMedica. Источник: http://wm-vision.com/en/product/hema
Fig. 17. Микроскопы WestMedica. Source: http://wm-vision.com/en/product/hema
Помимо микроскопов-сканеров, используемых в специализированных патологоанатомических лабораториях, в настоящее время создаются более доступные по стоимости и процессу создания аналоги для оцифровки микроскопических препаратов.
Вариантом «карманного» микроскопа является uHandy. Масса микроскопа составляет 70 гр, корпус состоит из LED источника света, небольшой батареи и линзы. Изображение выводится с помощью камеры смартфона с прикрепленной к ней линзой. Варианты линз включают в себя так называемые Lo-Mag Lens с увеличением 10-120x и HiMag Lens с увеличением 30-360x и максимально 800-1000x, что сопоставимо с требованиями, предъявляемыми к стандартным световым микроскопам. Eric Mbuthia Kanyi и соавт. использовали данный микроскоп для быстрого анализа бактериальных и протозойных заболеваний в местах, где не доступна медицинская помощь. Проверка качества получаемого изображения проводилась с помощью сравнения μHandy и светового микроскопа. Результаты показали, что портативный микроскоп не способен зафиксировать большую часть признаков наличия протозойных заболеваний в мазке. Однако ограничением данного исследования является использование стандартных предметных стекол, тогда как разработчики uHandy предлагают использование собственных стикеров, наклеиваемых на стекло так, что объект исследования находится между куполом стикера и стеклом. Таким образом, портативные микроскопы требуют дальнейших исследований, улучшений и апробации для использования в клинической практике [47].
https://www.loveuhandy.com/features"
src="https://jtelemed.ru/sites/default/files/img/magazine4/jt3/jt3_18.png" style="width:50%" />
Рис. 18. uHandy. Источник: https://www.loveuhandy.com/features
Fig. 18. uHandy. Source: https://www.loveuhandy.com/features
Большие размеры лабораторных микроскопов, их значительная стоимость и небольшая доступность, привели к идее создания напечатанного на 3D-принтере микроскопа. James P. Sharkey и соавт. создали компактный микроскоп, тело которого возможно самостоятельно напечатать на 3D-принтере. Потенциал данного устройства заключается в открытом доступе 3D-модели, которая может передаваться и модифицироваться другими пользователями. Кроме того, авторы предлагают не только открытый доступ, но и печать микроскопа монолитом, т.е. с минимальным количеством деталей, которые необходимо собрать. Поскольку микроскоп является прибором, где точность постановки препарата и камеры значительно влияет на конечное получаемое изображение, печать цельной детали снижает вероятность ошибок сборки и появления неточностей в собранном виде. В ходе разработки 3D-модели учитывалась так же эластичность ее тонких элементов, а увеличительная линза была использована из модуля камеры Raspberry Pi. Данный микроскоп позволяет получить увеличение, сравнимое с увеличением 10x или 20x классического светового микроскопа. Таким образом, простота печати, сборки и использования данной разработки, а также высокая доступность позволяет использовать его в исследованиях, где значительную роль играют размеры и масса микроскопа [48].

Рис. 19. Sharkey J. P. и соавт. A one-piece 3D printed flexure translation stage for open-source
microscopy // Review of Scientific Instruments. 2016. № 2 (87). C. 025104
Fig. 19. Sharkey J. P. et al. A one-piece 3D printed flexure translation stage for open-source microscopy //
Review of Scientific Instruments. 2016. № 2 (87). C. 025104
Таблица 2. Сравнение характеристик микроскопов для WSI
Table 2. Comparison of characteristics of microscopes for WSI
| Виды микроскопии/ Types of microscopy |
Вместимость (стандартных стекол)/ Standard glass capacity |
Увеличение/ Magnification |
Время сканирования (15x15 мм) /
Scan time |
Форматы изображения / Image formats |
Размеры, масса сканера / Dimensions, weight of the scanner |
Наличие собственного ПО / Own software |
Наличие регистрации / Registration |
|
|---|---|---|---|---|---|---|---|---|
| Aperio (Leica Biosystems) | Светлопольная, иммунофлюорес-центная, FISH, иммерсионная | 4 5 8 200 400 |
20x, 40x 1,25x, 2,5x, 5x, 10x, 63x | Versa 20x - 206 сек | - | Зависят от модели | + | CE IVD, FDA, RUO, Aperio AT и AT2 -регистрация в РФ |
| Philips IntelliSite Pathology Solution (PIPS) | Cветлопольная | 300 | 40x | 60 слайдов/час (~1 мин) | - | (656 x 933 x 587 см) и масса 139 кг | + | CE IVD FDA |
| Hamamatsu Nanozoomer | Светлопольная, иммунофлюорес-центная | 1 30 210 360 |
20x, 40x | 30 сек (для обоих увеличений) | JPEG | + | CE-IVDD Nanozoomer SQ C13140-21, Nanozoomer S60 C13210-01, Nanozoomer S210 С13239-01, Nanozoomer S360 Регистрация в РФ | |
| PathScan Enabler 5 | Cветлопольная | 2 | Эквивалентно 4x (просмотр) 50x | - | TIFF JPEG | 41x15x28 см | ||
| Slide Strider appliance | Светлопольная, иммунофлюорес-центная, иммерсионная | 8 200 |
10x, 20x, 40x | 2 мин | JPEG2000 | - | + | |
| Grundium | Cветлопольная | 1 | 20x, 40x | 40x- 1 мин 20x - 3 мин |
TIFF SVS | 18x18x19 см, масса 3,5 кг | RUO CE-IVD |
|
| uScopes | Cветлопольная | 1 | 20x, 40x, 60x | 20x - 6 мин 40x - 22 мин 60x - 49 мин |
Deep Zoom Pyramid Tiled TIFF(SVS) Easy Zoom (SZI) | 10,4x16,9x22,4 мм 2,7 кг | + | |
| VisionTek | Cветлопольная | 4 | 2.5x, 5x, 10x, 20x, 40x, 63x | 1,5 мин (VisionTek M6) 3,0 мин (VisionTek) | 40,5x52x45,5 см 35 кг | + | RUO | |
| Tissuegnostics | Светлопольная, конфокальная, иммуногистохимия светлопольная | 8 120 |
2,5x-100x | 2 мин | TissueFAXS, OME-TIFF, TIFF, JPEG, BMP, PNG | - | + | RUO |
| Huron Digital Pathology | Cветлопольная | 400 | 20x, 40x | >1 мин | DICOM | Зависит от модели | + | CE-IVD |
| ЕКОС | Светлопольная, люминесцентная | 1 4 8 50 200 |
4x, 20x, 40x, 60x, 100x | 20x - 20-40 сек 40x - 60-120 сек |
MECOS SVS DZI JPEG2000 | + | Регистрация в РФ | |
| Zeiss Axioscan | Cветлопольная, флюоресцентная и поляризационная | 12 100 |
10x, 20x, 40x | 10x10 мм: 20x 1 мин 13 сек; 5 мин 23 сек |
- | Зависит от модели | + | Не для клинического использования |
| VENTANA DP 200(Roche) | Cветлопольная | 6 | 20x, 40x | 20x - 49 сек 40x - 85 сек |
DICOM | 49,78x67,82x 46,23 см, <48 кг | + | CE-IVD VENTANA iScan HT -регистрация в РФ |
| SLIDEVIEW VS200 (Olympus) | Cветлопольная, темнопольная, поляризационная, флюоресцентная и фазово-контрастная | 210 | 20x, 40x, 60x, 100x | - | - | - | + | RUO |
| OSPITEX INTERNATIONAL | Cветлопольная | До 200 | 40x | - | - | Зависит от модели | + | + |
| 8 (Histo-Line Laboratories) | Cветлопольная | 1 | - | CE-IVD | ||||
| DiaPath | Светлопольная, поляризационная | - | CE | |||||
| Glissando | Cветлопольная | До 20 | 20x, 40x | - | - | Зависит от модели | + | CE-IVD ISO RUO |
| ANNORAMIC (3DHISTECH) | Светлопольная, флюоресцентная | 1 11 12 150 250 1000 |
60x, 80x | 35 сек - 8 мин (20x) Для флюорецсент-ной: 5-18 мин (31x) 15-70 мин (62x) | DICOM Tiled TIFF | Зависит от модели | + | ISO Регистрация в РФ |
| WestMedica | Светлопольная, иммерсионная | 1 4 8 200 |
10x, 20x, 50x, 60x, 100x | - | - | Зависит от модели | + | |
| uHandy | Cветлопольная | 1 | Эквивалентно 10-1000x (1-100x ?) | - | - | 70 г | + | |
| Sharkey и соавт. | Cветлопольная | 1 | Эквивалентно 10x, 20x | - | - | - | - |
ОБСУЖДЕНИЕ
Обзор возможных решений показывает активное развитие цифровой патологии, появление целых систем, включающих в себя не только микроскоп и программное обеспечение, но и объединение врачей из разных городов и стран. Появившиеся системы микроскопии позволяют проводить анализ одновременно несколькими врачами, что увеличивает качество постановки диагноза. Кроме того, благодаря удаленному доступу к оцифрованным данным перспективно использование подобных аппаратов в удаленных городах, где имеется дефицит специалистов при высокой потребности в данном методе диагностики. Опыт Норвегии показал высокую эффективность применения телепатологии в небольших населенных пунктах [50].
Применение WSI позволяет собирать массивы данных в научных исследованиях, на основе которых возможно глубокое машинное обучение для распознавания паттернов различных заболеваний, что также значительно облегчает работу врача-патологоанатома. Более подробный, чем при стандартной световой микроскопии, анализ возможен благодаря функционалу программных обеспечений – измерению расстояния между тканевыми структурами на препарате, выделению участков интереса, комментированию структур.
Кроме того, применение WSI показало свою эффективность в обучении будущих специалистов благодаря наглядности материала и возможности более продуктивного взаимодействия студентов и преподавателей.
Актуальность использования автоматизированных микроскопов подтверждается мультицентровыми исследованиями, в основу которых легло использование технологии WSI, без которой сбор большого количества патологоанатомических данных был бы невозможен [14]. Кроме того, в настоящее время сканирование микроскопических препаратов применяется в ветеринарии для диагностики опухолей у млекопитающих [50]. Расширение сфер применения цифровой патологии показывает активное развитие данной сферы медицины и диагностики.
Среди ограничений применения цифровых технологий в патологической анатомии возможно выделить сложности, связанные с оцифровкой разных видов препаратов для микроскопии. Так, например, значительное влияние на скорость анализа врачами-патологоанатомами оказывает цветопередача как компьютера, выводящего изображение ткани, так и камеры, фиксирующей изображение со стекла [51]. Решением данной проблемы является использование цветокоррекции, которая включена в некоторых программные обеспечения микроскопов и позволяет создать свет, аналогичный используемому при просмотре стекол специалистов через окуляр микроскопа. Создаются алгоритмы на основе искусственного интеллекта, которые автоматически стандартизируют и корректируют цвет на отсканированном снимке [52].
Другим ограничением является выявленная в ходе мультицентровых исследований разница во времени, которое врач-патологоанатом тратит на анализ препарата на световом микроскопе и с помощью технологии WSI. В случае с оценкой оцифрованного препарата время, затраченное на его просмотр, незначительно больше. Однако данная разница может быть связана с отсутствием опыта в работе с новым способом анализа. Более того, результаты исследований показали сопоставимость точности диагнозов, поставленных с помощью просмотра оцифрованных препаратов и стандартным методом. Важно отметить, что высокая скорость сканирования с помощью автоматизированных микроскопов, а также потенциальное применение искусственного интеллекта для помощи в определении гистологических структур и постановке диагноза в совокупности снизят общую нагрузку на врача-патологоанатома, что нивелирует разницу во времени анализа изображения. Кроме того, программы для микроскопов позволяют хранить в цифровом виде не только изображения патологоанатомических препаратов, но и документацию пациента, что также облегчает работу с большими объемами данных.
Другие ограничения связаны со сферой правового регулирования применения цифровой патологии в медицине. Использование медицинских устройств требует специальной регистрации, что значительно ограничивает возможности применения большинства микроскопов в клинической практике. Однако это является временным препятствием, поскольку в настоящее время активное развитие данной сферы медицины стимулирует компании к получению регистраций и разрешений на внедрение устройств в лабораторную диагностику. FDA выделяют необходимость регулирования в цифровой патологии таких аспектов, как стандартизация методов, применяемых в сканировании патологоанатомических препаратов, а также ограничения в применении искусственного интеллекта и глубокого машинного обучения для поддержки врачей-патологоанатомов в интерпретации цифровых данных [53]. К аналогичным ограничениям относятся вопросы правового регулирования передачи данных пациентов.
На основе проведенного обзора возможно создание классификации имеющихся в настоящее время микроскопов, предназначенных для автоматизированного сканирования стекол с патологоанатомическими, гистологическими и другими препаратами.
КЛАССИФИКАЦИЯ МИКРОСКОПОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ПОЛНОГО СКАНИРОВАНИЯ СТЕКОЛ (WSI)
1. Микроскопы-сканеры
Данные микроскопы получили значительное распространение в патологоанатомических лабораториях и в настоящее время применяются в том числе и в России. Сканеры представляют собой закрытые системы микроскопии, в которых камеры и объективы находятся внутри устройства, а загрузку патологоанатомических препаратов можно сравнить с работой дисковода. В сканеры, используемые в лабораториях, возможно загрузка в среднем до 400 стекол. В совокупности с высокой скоростью сканирования, работа такого микроскопа значительно оптимизирует работу с патологоанатомическим материалом. Стандартное увеличение, используемое в сканерах, это x20 и x40, а скорость сканирования достигает около минуты и менее на одно стекло. На микроскопах чаще всего возможно осуществление светлопольной микроскопии и иммуногистохимии. Функция «экстренного сканирования» позволяет производить сканирование препаратов вне очереди, что является преимуществом в ситуациях, где нет возможности ожидать снимок. Однако значительным ограничением является необходимость использования устройств для окраски препаратов и специальной их подготовки, что необходимо для полноценной работы данных микроскопов, поскольку сканеры могут работать только с проприетарным видом стекол, и размеры стекол, толщина среза и его покрытие значительно влияют на качество и в целом возможность оцифровки. По этой причине, а также высокой стоимости данных устройств, их применение в удаленных лабораториях ограничено. Размеры и масса микроскопов так же связаны с целью их применения только в крупных центральных лабораториях и больницах. Другим ограничением является закрытость самой системы микроскопии, что определяет небольшой выбор увеличений и видов микроскопии, а сканеры для специализированных методов микроскопии, таких как иммунофлюоресцентный, являются отдельными устройствами. Таким образом, характеристики микроскопов-сканеров позволяют их применять только в крупных лабораториях с высоко стандартизированными методами проведения патологоанатомических исследований, в которых многие шаги автоматизированы. С одной стороны, это повышает качество данного вида исследования, с другой стороны, высокая стоимость оборудования препятствует применению систем микроскопии для замены врачей-патологоанатомов и лаборантов в районных больницах и лабораториях.
2. Микроскопы, внешне сходные со световыми
Такие аппараты имеют размеры, аналогичные или незначительно меньше размеров стандартных световых микроскопов. Внешнее сходство определяется открытостью сканирующих частей и наличием платформы, осуществляющей автоматическое передвижение и имеющей место для 1-8 стандартных предметных стекол, сменных объективов, с помощью которых возможно сканирование препаратов на разных увеличениях. Осветитель также чаще всего расположен под предметным стеклом, а камера, фиксирующая передвижения препарата – над объективом, иногда – вместо окуляра. Открытость данной системы позволяет проводить множество видов микроскопии, поскольку смена объектива и свободный доступ лаборанта к предметным стеклам обеспечивают проведение масляной иммерсионной микроскопии, а добавление флюоресцентных источников света делает возможным иммунофлюоресцентный и другие виды микроскопии. Такие микроскопы так же часто поддерживают темнопольную микроскопию. Проблема небольшого количества стекол, для которых возможно запустить в последовательное сканирование, обычно решается добавлением специального кейса, емкость которого равна до 200 слайдов. Время, затрачиваемое на сканирование, обычно не отличается, либо незначительно больше, чем у микроскоповсканеров. Значительным преимуществом большинства подобных сканеров является использование любых видов предметных стекол, без специальной подготовки материала. Такое преимущество делает возможным применение данных микроскопов в небольших лабораториях или удаленных больницах, где выбор лабораторных диагностических устройств значительно зависит от их стоимости. Возможность сканирования не только стандартных препаратов с окраской гематоксилин-эозин, но и замороженных срезов, иммуногистохимических и иммунофлюоресцентных стекол значительно расширяют области применения таких устройств.
3. Компактные микроскопы, по размерам сопоставимые или меньше смартфона
Такие устройства разнообразны по исполнению и форме. Возможно выделить микроскопы, использующие собственную камеру для создания снимков, и устройства, требующие наличие смартфона с камерой. Преимуществом данных микроскопов являются небольшие размеры, а также возможность печати некоторых вариантов на 3D принтере, что делает такую методику микроскопии широко доступной благодаря низкой стоимости и открытому доступу к 3D моделям. Однако такие микроскопы используются для визуализации структур, требующих небольшое увеличение, что ограничивает применение данных устройств в патологической анатомии. Использование камеры смартфона также влияет на качество получаемого изображение, и потому оно напрямую зависит от разрешения камеры. Кроме того, не все микроскопы работают по технологии WSI и возможность сканирования патологоанатомического материала полностью не всегда осуществима. Помимо неудобств, связанных с частичной оцифровкой изображения, не все устройства могут сканировать предметные стекла и требуют применения собственных способов фиксации препаратов. Поэтому в настоящее время «карманные» микроскопы могут быть применены скорее для обучения в биологии, энтомологии и ботанике, чем для клинической диагностики в патологической анатомии.
4. Световые микроскопы с «навесным» оборудованием для сканирования
Основой таких систем микроскопии является стандартный микроскоп, к которому крепится оборудование, позволяющее автоматизировать процесс сканирования. Например, с помощью печати деталей на 3D принтере, было создано устройство для высокоразрешающей микроскопии [54]. Такой способ, несмотря на отсутствие промышленного производства, по качеству микроскопии может быть сопоставим с микроскопами из пунктов 1 и 2, поскольку продуманное моделирование деталей минимизировало возможные люфты и недостатки, связанные материалом, используемым в печати. Использование навесных деталей может иметь большой потенциал применения в цифровой патологии, поскольку значительно снижает стоимость устройства. Стандартизация деталей позволит создать сканер на базе любого светового микроскопа, а качество и скорость сканирования потенциально приближена к аналогичным характеристикам у микроскопов пункта 2. Кроме того, возможно создание устройств, сканирующих любые виды предметных стекол, что также делает данные микроскопы доступными для применения в любых лабораториях.
Таблица 3. Преимущества и недостатки различных видов микроскопов для сканирования стекол
Table 3. Advantages and disadvantages of different types of microscopes for scanning glass
| Преимущества | Недостатки | |
|---|---|---|
| Микроскопы, внешне сходные со световыми | 1. Относительно компактные размеры 2. Использование в операционной 3. Использование различных вариантом микроскопии на одной модели 4. Использование многих вариантов увеличения 5. Небольшая пропускная способность решается дополнительным кейсом для слайдов |
1. Возможно более длительное сканирование, чем у микроскопов-сканеров |
| Микроскопы-сканеры | 1. Возможность сканирования большого количества стекол 2. Высокая скорость сканирования 3. Применение в клиниках и больших лабораториях |
1. У большинства - ограничение модели по использованию нескольких видов микроскопии 2. Большие размеры и масса (до 140 кг) 3. Использование только специально подготовленных стекол |
| Компактные микроскопы, по размерам сопоставимые или меньше смартфона | 1. Небольшие размеры и масса 2. Возможность печати деталей на 3D принтере |
1. Ограничение качества изображения, связанное с разрешением камеры смартфона 2. Ограничение применения в патологоанатомии, связанные со способом фиксации препаратов непривычными стеклами |
| Световые микроскопы с «навесным» оборудованием для сканирования | 1. Возможность создание сканера на базе любого или практически любого микроскопа 2. Возможность 3D печати деталей |
Связаны с ограничениями используемого микроскопа |
ВЫВОДЫ
Проведенный обзор литературы показал широкие возможности применения полного сканирования морфологических материалов. Очевидна актуальность и потребность использования оцифровки гистологических и цитологических препаратов во всех сферах медицины, научной и учебной деятельности. Широкое применение в научных исследованиях – поисках маркеров патологий, разработке анализа патологоанатомических изображений на базе искусственного интеллекта, а также удобство в сравнении эффективности лечения в проспективных исследованиях, обеспечивается возможностью длительного хранение отсканированных изображений. Оцифровка не только препаратов с окраской гематоксилин-эозин, но и иммуногистохимии, применение флюоресцентных методов микроскопии, отвечает современным методам исследования и диагностики заболеваний. Доступ к данным с помощью интернета из любой точки дает возможность создания консилиумов врачей, в том числе междисциплинарных, что значительно влияет на качество анализа. Развивающаяся сфера телемедицины – телепатология – создает потребность в разработке новых технологий, в том числе микроскопов для сканирования и программ для анализа и хранения полученных изображений.
ЛИТЕРАТУРА
- Jahn SW, Plass M, Moinfar F. Digital Pathology: Advantages, Limitations and Emerging Perspectives. JCM 2020;9(11):3697.
- Niazi MKK, Parwani AV, Gurcan MN. Digital pathology and artificial intelligence. The Lancet Oncology 2019;20(5):e253–61.
- Состояние и основные задачи развития патолого-анатомической службы Российской Федерации: Отраслевое статистическое исследование за 2020 год. [Электронный ресурс]. URL: http://patolog.ru/sites/default/files/analiticheskiy_doklad_2020sh.pdf. [Sostoyanie i osnovnyie zadachi razvitiya patologo-anatomicheskoy sluzhbyi Rossiyskoy Federatsii: Otraslevoe statisticheskoe issledovanie za 2020 god. [Elektronnyiy resurs]. URL: http://patolog.ru/sites/default/files/ analiticheskiy_doklad_2020sh.pdf. (in Russian)].
- Fertig RM, Sangueza O, Gaudi S, Gamret AC, Cervantes J, Jukic DM. Whole Slide Imaging. The American Journal of Dermatopathology 2018;40(12):938–9.
- Commissioner O of the Press Announcements – FDA allows marketing of first whole slide imaging system for digital pathology 2017. [Electronic resource]. URL: https://www.fda.gov/ NewsEvents/Newsroom/PressAnnouncements/ucm552742.htm
- Borowsky AD, Glassy EF, Wallace WD, Kallichanda NS, Behling CA, Miller DV, et al. Digital Whole Slide Imaging Compared With Light Microscopy for Primary Diagnosis in Surgical Pathology. Archives of Pathology & Laboratory Medicine 2020;144(10):1245–53.
- Mukhopadhyay S, Feldman MD, Abels E, Ashfaq R, Beltaifa S, Cacciabeve NG, et al. Whole Slide Imaging Versus Microscopy for Primary Diagnosis in Surgical Pathology: A Multicenter Blinded Randomized Noninferiority Study of 1992 Cases (Pivotal Study). American Journal of Surgical Pathology 2018;42(1):39–52.
- Ryan ST, Zhang J, Burner DN, Liss M, Pittman E, Muldong M, et al. Neoadjuvant rituximab modulates the tumor immune environment in patients with high risk prostate cancer. J Transl Med 2020;18(1):214.
- 9. Sethi A, Sha L, Kumar N, Macias V, Deaton RJ, Gann PH. Computer vision detects subtle histological effects of dutasteride on benign prostate. BJU Int 2018;122(1):143–51.
- Earl HM, Hiller L, Dunn JA, Blenkinsop C, Grybowicz L, Vallier A-L, et al. Efficacy of neoadjuvant bevacizumab added to docetaxel followed by fluorouracil, epirubicin, and cyclophosphamide, for women with HER2-negative early breast cancer (ARTemis): an open-label, randomised, phase 3 trial. The Lancet Oncology 2015;16(6):656–66.
- Ali HR, Dariush A, Thomas J, Provenzano E, Dunn J, Hiller L, et al. Lymphocyte density determined by computational pathology validated as a predictor of response to neoadjuvant chemotherapy in breast cancer: secondary analysis of the ARTemis trial. Annals of Oncology 2017;28(8):1832–5.
- Lam AK, Leung M. Whole-Slide Imaging of Esophageal Squamous Cell Carcinoma. В: Lam AK, editor. Esophageal Squamous Cell Carcinoma. [Electronic resource]. New York, NY: Springer US 2020;107–17 p. (Methods in Molecular Biology; т. 2129). URL: http://link.springer.com/10.1007/978-1-0716-0377-2_9
- Steele KE, Tan TH, Korn R, Dacosta K, Brown C, Kuziora M, et al. Measuring multiple parameters of CD8+ tumor-infiltrating lymphocytes in human cancers by image analysis. J immunotherapy cancer 2018;6(1):20.
- Skrede O-J, De Raedt S, Kleppe A, Hveem TS, Liestїl K, Maddison J, et al. Deep learning for prediction of colorectal cancer outcome: a discovery and validation study. The Lancet 2020;395(10221):350–60.
- Luhtala S, Haapaniemi T, Staff S, Isola J. Fluoro-Chromogenic Labelling for Detection of MCM2 to Assess Proliferation Activity in HER2-amplified Breast Carcinomas. Appl Immunohistochem Mol Morphol 2020;28(3):175–86.
- Evans AJ, Depeiza N, Allen S-G, Fraser K, Shirley S, Chetty R. Use of whole slide imaging (WSI) for distance teaching. J Clin Pathol 2021;74(7):425–8.
- McDaniel MJ, Russell GB, Crandall SJ. Innovative Strategies for Clinical Microscopy Instruction: Virtual Versus Light Microscopy. J Physician Assist Educ 2018;29(2):109–14.
- Montironi R, Cimadamore A, Scarpelli M, Cheng L, LopezBeltran A., Mikuz G. Pathology without microscope: From a projection screen to a virtual slide. Pathology – Research and Practice. Pathol Res Pract 2020;216(11):153196.
- Rocco B, Sighinolfi MC, Cimadamore A, Reggiani Bonetti L, Bertoni L, Puliatti S, et al. Digital frozen section of the prostate surface during radical prostatectomy: a novel approach to evaluate surgical margins. BJU Int 2020;126(3):336–8.
- Philips IntelliSite Pathology Solution. [Electronic resource]. URL: https://www.usa.philips.com/healthcare/resources/landing/philips-intellisite-pathology-solution.
- Leica Byosystems. [Electronic resource]. URL: https://www.leicabiosystems.com/digital-pathology/scan/.
- Aperio Scanscope CS. [Electronic resource]. URL: http://www.lri.se/pdf/aperio/LRI_ScanScope_cs_new.pdf.
- Hamamatsu Nanozoomer. [Electronic resource]. URL: https://nanozoomer.hamamatsu.com/jp/en/scanner/search.html
- NanoZoomer S60 Digital slide scanner C13210-01. [Electronic resource]. URL: https://nanozoomer.hamamatsu.com/ jp/en/scanner/search/C13210-01/index.html.
- NanoZoomer S360 Digital slide scanner C13220-01. [Electronic resource]. URL: https://nanozoomer.hamamatsu.com/ jp/en/scanner/search/C13220-01/index.html.
- Slide Strider appliance (Jilab Inc., Tampere, Finland). [Electronic resource]. URL: https://jilab.fi/index.php/digital-pathology-scanners-and-software/.
- Slide Strider Ducenti. [Electronic resource]. URL: https://jilab.fi/wp-content/uploads/2020/01/slidestrider.pdf.
- Slide Strider Octo. [Electronic resource]. URL: https://jilab.fi/wp-content/uploads/2020/01/slidestrider_octo.pdf
- Grundium. [Electronic resource]. URL: https://grundium.com
- Microscopes international. [Electronic resource]. URL: https://www.microscopesinternational.com/default.aspx.
- Glissando DesktopTM Scanner. [Electronic resource]. URL: http://www.objectiveimaging.com/Glissando/Glissando-Scanner.php.
- Meyer instruments. [Electronic resource]. URL: https://www.meyerinst.com/pathscan-enabler-5/.
- Sakura. [Electronic resource]. URL: https://www.sakuraus.com.
- Tissuegnostics. [Electronic resource]. URL: https://tissuegnostics.com.
- Huron Digital Pathology. [Electronic resource]. URL: https://www.hurondigitalpathology.com.
- Mecos. [Electronic resource]. URL: https://www.mecos.ru
- Сканер MECO-SCAN. [Electronic resource]. URL: https://www.mecos.ru/DEMO/Spec%20SCAN%20rus.pdf.
- ZEISS. [Electronic resource]. URL: https://www.zeiss.com/ microscopy/int/products/imaging-systems/axioscan-for-biology.html.
- 3DHISTECH. [Electronic resource]. URL: https://www.3dhistech.com/research/pannoramic-digital-slide-scanners/pannoramic-250-flash-iii/.
- ROCHE. [Electronic resource]. URL: https://www.roche.com.
- VENTANA DP 200 slide scanner. [Electronic resource]. URL: https://diagnostics.roche.com/global/en/products/instruments/v entana-dp-200.html.
- Olympus. [Electronic resource]. URL: https://www.olympuslifescience.com/en/solutions-based-systems/vs200/.
- HOSPITEX INTERNATIONAL. [Electronic resource]. URL: https://www.hospitex.com/en/prodotto/cytofast-digital-vision-4/.
- Histo-Line Laboratories. [Electronic resource]. URL: https://histoline.com/en/hlm8.
- DiaPath. [Electronic resource]. URL: https://www.diapath.com.
- WestMedica. [Electronic resource]. URL: http:// wm-vision.com.
- Eric Mbuthia Kanyi, Lydia Mwangasha. Digital Microscopy: Making Diagnostics More Accessible. [Electronic resource]. URL: https://www.psqh.com/analysis/digital-microscopy-making-diagnostics-more-accessible/.





































