ВВЕДЕНИЕ
Оценка биологической зрелости организма является одной из ключевых задач в педиатрической практике. Наиболее объективным маркером биологического возраста признан «костный возраст» (КВ) – условная величина, отражающая степень оссификации скелета по сравнению со стандартными популяционными показателями [1]. Расхождение между паспортным (хронологическим) и костным возрастом служит важным диагностическим критерием для широкого спектра патологий.
Для врачей-детских эндокринологов определение КВ необходимо при дифференциальной диагностике вариантов задержки роста (конституциональная задержка, соматотропная недостаточность, гипотиреоз) и форм преждевременного полового развития. Точная оценка костного созревания критически важна для принятия решения о начале терапии гормоном роста (рГР) или аналогами гонадотропин-рилизинг гормона, а также для мониторинга эффективности лечения [2]. Ошибки в определении КВ могут привести к неверному прогнозу конечного роста ребенка и необоснованному на значению дорогостоящей и длительной терапии.
В практике травматологов-ортопедов данные о костном возрасте используются для прогнозирования пика ростового скачка, что имеет решающее значение при лечении идиопатического сколиоза (определение времени корсетотерапии или хирургической коррекции) и при хирургическом выравнивании длины нижних конечностей (расчет времени эпифизеодеза) [3]. Недоценка стадии оссификации может привести к упущенному «терапевтическому окну» или, наоборот, к слишком раннему и агрессивному вмешательству.
Для педиатров оценка КВ является инструментом скрининга общего соматического статуса, позволяя выявлять детей, чье физическое развитие отклоняется от нормы вследствие хронических заболеваний, нарушений питания или психосоциальных факторов.
На сегодняшний день «золотым стандартом» определения КВ остается рентгенография кисти и лучезапястного сустава. Это обусловлено минимальной лучевой нагрузкой, большим количеством зон роста в данной анатомической области и наличием стандартизированных методик оценки. Наиболее распространенными в мире являются методы Грейлиха-Пайл (G&P) и Таннера-Уайтхауса (TW2/TW3). Метод G&P основан на визуальном сравнении рентгенограммы пациента с изображениями в атласе, созданном в 1950-х годах на основе выборки детей европеоидной расы из США [4]. Метод TW подразумевает балльную оценку степени зрелости отдельных костей (обычно 13 или 20 зон интереса) с последующим расчетом суммарного индекса [5].
Несмотря на широкое распространение, мануальные методы обладают существенными недостатками:
- Исследования показывают высокую межэкспертную (inter-observer) и внутриэкспертную (intra-observer) вариабельность. Разброс значений при оценке одного и того же снимка разными специалистами может достигать 0,5–1,0 года [6].
- Детальная оценка по методу TW3 может занимать до 15–20 минут, что неприемлемо в условиях высокой загруженности рентгенологических отделений. Экспресс-оценка по атласу G&P быстрее, но менее точна.
- Атлас G&P основан на данных детей, родившихся в первой половине XX века в Северной Америке. Темпы акселерации и этнические особенности современных детей, в том числе в Российской Федерации, могут существенно отличаться от эталонных значений, что требует адаптации методик или использования больших локальных данных [7].
В связи с этим, автоматизация процесса оценки КВ с помощью технологий искусственного интеллекта (ТИИ) и глубокого обучения (Deep Learning) представляется логичным и необходимым шагом эволюции лучевой диагностики. В мировой практике существуют коммерческие решения (например, BoneXpert, VUNO Med-BoneAge), однако их внедрение в РФ ограничено высокой стоимостью, вопросами локализации данных и необходимостью импортозамещения программного обеспечения.
Научная новизна настоящей работы заключается в создании и валидации первого полностью отечественного комплексного решения на базе сверхточных нейронных сетей для автоматизированной оценки КВ, адаптированного к особенностям работы в системе ЕМИАС и учитывающего специфику российской популяции.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на базе ГБУЗ «НПКЦ ДиТ ДЗМ» (Москва). Дизайн исследования – ретроспективное, мультицентровое, наблюдательное.
В исследовании разработана нейросетевая модель для автоматизированной оценки КВ, адаптированная к российской популяции. Теоретико-методологическая база включает анализ классических алгоритмов обработки медицинских изображений (BoneXpert) и сверточных нейронных сетей (VUNO Med BoneAge и Gleamer BoneAge) для задачи определения КВ [1–3]. В работе применены алгоритмы машинного зрения для предобработки медицинских изображений, детекции (YOLOv11, точность 98%) и сегментации кисти (U-Net, IoU 0,95). Для регрессии костного возраста использована модель ResNet50, обученная на комбинированном датасете из 12 811 рентгенограмм (RSNA Challenge и ЕРИС ЕМИАС).
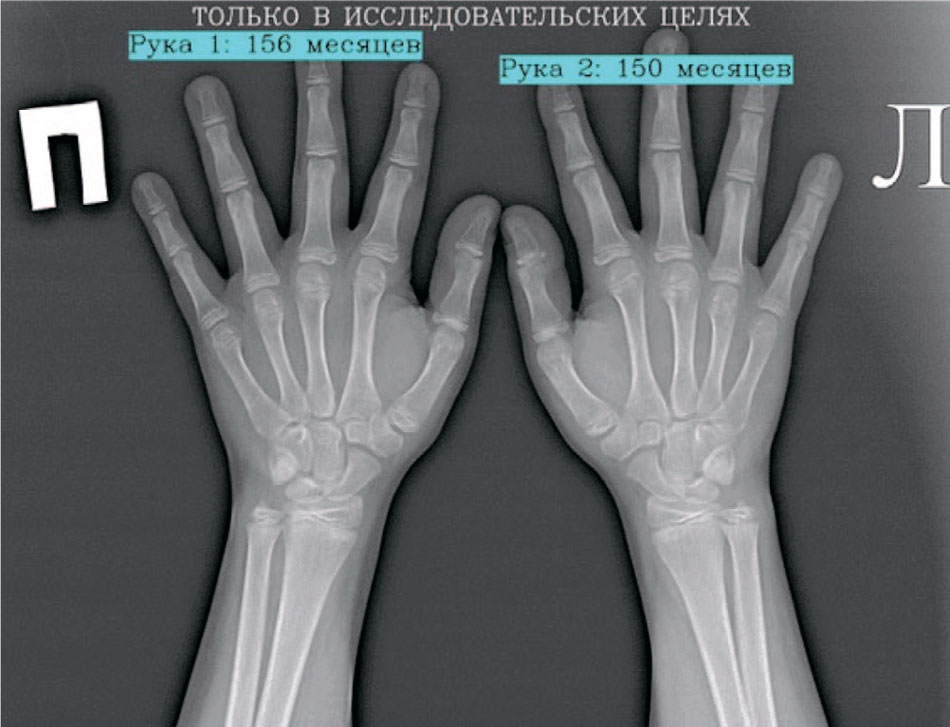
Рис. 1. Пример аннотированного изображения с выводом костного возраста для исследования из ЕРИС ЕМИАС
Fig. 1. Example of an annotated image with bone age output for research from ERIS EMIAS
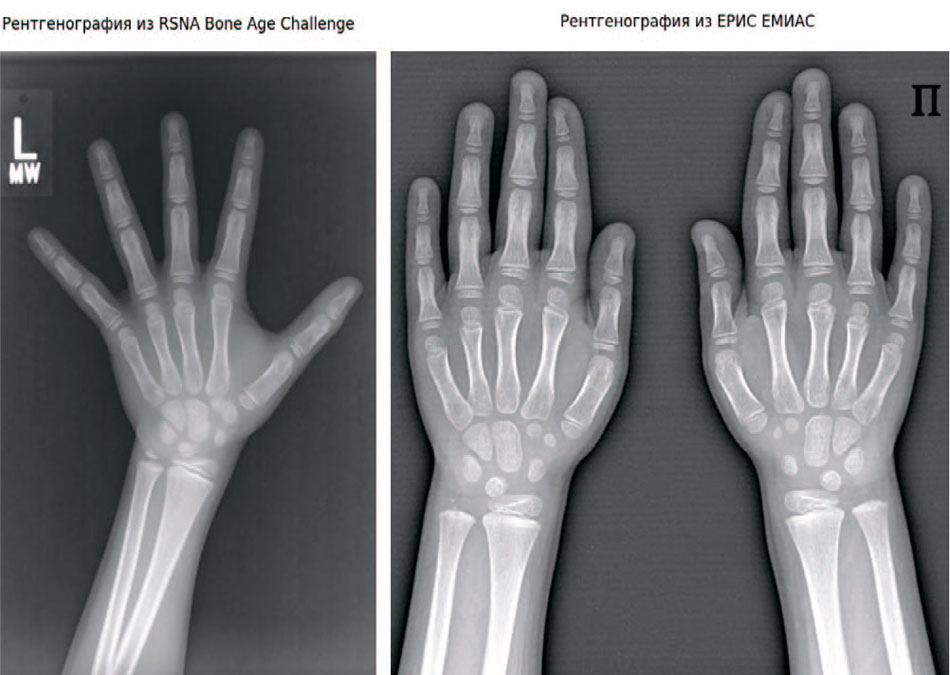
Рис. 2. Методологиями проведения рентгенографии кисти в РФ и США
Fig. 2. Methodologies for performing hand radiography in the Russian Federation and the USA
Характеристика наборов данных (Dataset)
Для разработки модели использован комбинированный датасет, обеспечивающий как разнообразие обучающих примеров, так и релевантность целевой популяции:
- RSNA Pediatric Bone Age Challenge (США). Основной массив данных для обучения, включающий 12 611 анонимизированных рентгенограмм кисти детей в возрасте от 0 до 19 лет. Данный набор является международным эталоном для задач машинного обучения в области оценки КВ [8].
- ЕРИС ЕМИАС (РФ, Москва). Для дообучения и независимого тестирования (валидации) использовано 200 рентгенограмм высокого разрешения из Единой радиологической информационной системы города Москвы. Эти данные критически важны для проверки устойчивости модели к качеству изображений отечественного рентгеновского оборудования и особенностям укладки, принятым в РФ.
Был проведен разведочный анализ данных (EDA), который выявил дисбаланс классов с преобладанием возрастных групп 5–15 лет. Для устранения этого фактора на этапе обучения применялась стратификация данных по возрастным интервалам и метод взвешенного сэмплирования (WeightedRandomSampler), что позволило модели равномерно обучаться на примерах всех возрастных групп, включая новорожденных и подростков старшего возраста.
Архитектура системы и алгоритмы обработки
Разработанный программный конвейер (pipeline) состоит из нескольких последовательных этапов, реализующих принцип «от общего к частному»:
Предобработка и нормализация.
Входные изображения (форматы DICOM, PNG, JPG) подвергаются линейной нормализации гистограммы. Яркость пикселей приводится к диапазону [0, 255], что нивелирует различия в экспозиции снимков, полученных на разных аппаратах.
Детекция области интереса (ROI).
Для автоматического обнаружения кисти на рентгенограмме использована современная архитектура YOLOv11 в связке с GroundedDINO. Модель обучена находить кисть и исключать посторонние объекты (маркеры стороны, артефакты, элементы коллимации). Точность детекции на тестовой выборке составила 98%.
Сегментация.
Выделенная область кисти передается в нейросеть архитектуры U-Net для создания бинарной маски (отделение костной и мягкой ткани от фона). Дополнительно применяются морфологические операции для удаления шумов и заполнения пустот внутри контура. Это позволяет подавать на вход регрессионной модели только информативную часть изображения, исключая влияние фона.
Регрессия костного возраста.
В качестве основы для предсказания возраста использована глубокая сверточная нейронная сеть ResNet50. Выбор данной архитектуры обусловлен ее доказанной эффективностью в задачах анализа медицинских изображений благодаря использованию остаточных связей, которые предотвращают затухание градиента при обучении глубоких сетей [9].
- Функция потерь. Использована L1 Loss (Mean Absolute Error – MAE), так как она менее чувствительна к выбросам по сравнению с MSE, что важно при наличии биологической вариабельности.
- Аугментация данных. Для повышения обобщающей способности модели применялась библиотека MONAI. Использованы методы геометрических преобразований: случайные повороты, масштабирование, отражение. Это позволяет имитировать различные варианты укладки пациента.
Валидация.
Использована 5-кратная перекрестная проверка, стратифицированная по полу и возрасту. Итоговая модель выбиралась на основе наилучшего баланса ошибки во всех возрастных когортах.
РЕЗУЛЬТАТЫ
Эффективность разработанной системы оценивалась метрикой средней абсолютной ошибки (Mean Absolute Error – MAE), которая показывает среднее отклонение предсказанного возраста от референтного (истинного) значения в месяцах. Количественные показатели точности:
На независимом тестовом наборе данных (из выборки ЕРИС ЕМИАС) получены следующие результаты:
- Мальчики: MAE = 7,77 месяца (95% ДИ: 6,8–9,9 в зависимости от возрастной группы).
- Девочки: MAE = 8,19 месяца (95% ДИ: 4,9–10,0 в зависимости от возрастной группы). Наилучшая точность достигнута в младших возрастных группах (0–24 мес.), где ошибка составила 3,74 мес. для мальчиков и 4,89 мес. для девочек. Некоторое увеличение ошибки в пубертатном периоде (133–180 мес.) до 9–10 месяцев коррелирует с естественной биологической вариабельностью темпов закрытия зон роста в этот период.
Сравнительный анализ:
Полученные показатели MAE (в среднем 7,9 мес.) демонстрируют существенное преимущество перед традиционными методами и сопоставимость с лучшими мировыми практиками:
- Атлас Грейлиха-Пайл (мануально): средняя ошибка составляет 12–18 месяцев из-за субъективности интерпретации и дискретных шагов атласа [10]. Разработанная модель точнее традиционного метода на 46%.
- Врач-эксперт: средняя вариабельность оценок опытных рентгенологов составляет около 12 месяцев [6]. Таким образом, точность ИИ-модели сопоставима с уровнем консилиума экспертов или превосходит его.
- Зарубежные аналоги (SOTA): В рамках RSNA Challenge лучшие алгоритмы показывали MAE на уровне 4,5–5,2 месяцев [8].
Незначительное отставание отечественной модели объясняется использованием гетерогенных данных реальной клинической практики РФ (ЕРИС ЕМИАС), которые сложнее для анализа, чем рафинированные конкурсные датасеты, однако полученный результат (MAE < 8–9 месяцев) полностью удовлетворяет клиническим требованиям для скрининга и мониторинга.
Временные характеристики:
Среднее время полного цикла обработки одного изображения (от загрузки до выдачи заключения) составляет менее 2 секунд. Для сравнения: качественная оценка по методу TW3 занимает у врача 10–20 минут, по методу G&P – 3–5 минут. Внедрение алгоритма позволяет сократить время, затрачиваемое рентгенологом на рутинную задачу, в десятки раз.
ОБСУЖДЕНИЕ
Разработанная система представляет собой не просто исследовательский проект, а готовый к внедрению продукт, имеющий высокую практическую значимость для врачей различных специальностей.
Значение для врачей-клиницистов
- Детская эндокринология. ИИ-система обеспечивает объективность в динамическом наблюдении. При лечении соматотропной недостаточности важно оценивать не только прибавку в росте, но и скорость закрытия зон роста. Субъективная ошибка врача в 6–12 месяцев может исказить картину эффективности терапии. Автоматизированная система, обладая фиксированной математической логикой, исключает фактор «усталости» или смены специалиста при повторных визитах.
- Травматология и ортопедия. Возможность мгновенного получения данных о костном возрасте позволяет ортопеду на амбулаторном приеме без ожидания описания рентгенолога рассчитать прогноз остаточного роста позвоночника. Это критически важно для своевременного назначения корсетирования по типу Шено при прогрессирующем сколиозе.
- Педиатрия. Простота использования веб-сервиса позволяет педиатрам первичного звена использовать КВ как дополнительный биомаркер здоровья. При выявлении значительного расхождения (более 2 стандартных отклонений) между паспортным и костным возрастом, система сигнализирует о необходимости углубленного обследования на предмет скрытых хронических патологий (целиакия, пороки сердца, почечная недостаточность).
Интеграция и доступность (Telemedicine & Digital Health)
Важным результатом работы является создание программного пакета на языке Python и развертывание веб-сервиса на платформе «MosMedSoft» (рис. 1, 2).
Система поддерживает работу с медицинским стандартом DICOM, что позволяет интегрировать ее непосредственно в PACS-системы медицинских учреждений (например, в ЕРИС ЕМИАС). Это реализует концепцию «бесшовной» работы: врач отправляет снимок на сервер и получает аннотированное изображение с рассчитанным возрастом и ближайшим эталоном из атласа. Для исследователей и разработчиков предусмотрен простой API, позволяющий интегрировать модуль оценки КВ в сторонние медицинские информационные системы (МИС) «в две строки кода».
Ограничения и перспективы
К ограничениям исследования можно отнести использование преимущественно данных датасета RSNA (популяция США) на этапе предварительного обучения. Несмотря на дообучение на российских данных, существуют антропометрические различия между популяциями. Дальнейшие шаги предполагают расширение отечественной выборки для калибровки модели, а также проведение проспективных клинических испытаний для оценки влияния использования ИИ на тактику ведения пациентов.
ЗАКЛЮЧЕНИЕ
Впервые в Российской Федерации разработано и зарегистрировано (Патент № 202566158) программное обеспечение на основе искусственного интеллекта для автоматического определения костного возраста у детей. Система демонстрирует высокую точность (MAE ~7,7–8,2 мес.), превосходящую традиционные мануальные методы, и радикально сокращает время анализа исследования (до 2 секунд).
Внедрение данной технологии в практику здравоохранения Москвы и регионов РФ позволит:
- Стандартизировать подход к определению биологического возраста, исключив субъективный фактор.
- Освободить время врачей-рентгенологов для решения более сложных диагностических задач.
- Повысить качество медицинской помощи детям с эндокринными и ортопедическими заболеваниями за счет точной и быстрой диагностики.
Продукт готов к клиническому применению и может быть масштабирован в рамках развития цифрового контура здравоохранения.





































